Cáncer de mama
1 de cada 8 mujeres desarrollará cáncer de mama en España. Gracias a pruebas de diagnóstico precoz más precisas y mejores tratamientos la supervivencia en cáncer de mama es de un 85%.
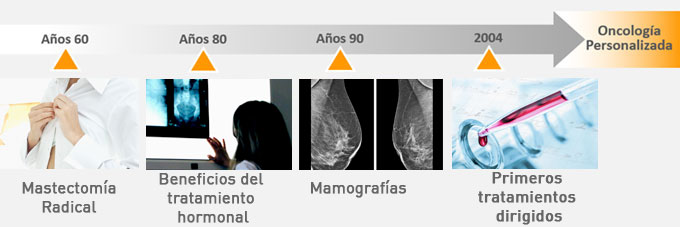
Los tratamientos en cáncer de mama han cambiado considerablemente en los últimos 40 años. En los años 60 la mastectomía radical era la única opción disponible y que no diferenciaba por tipo de cáncer, posteriormente se descubrió el uso del tamoxifeno como alternativa terapéutica a la quimioterapia en algunos subtipos de cáncer de mama en los años 80. La implantación de los programas de detección precoz de cáncer de mama en España supuso un hito, ya que con ello se consiguió detectar casos en fases iniciales suponiendo una mejora directa en las tasas de supervivencia de los pacientes. En 2004 empiezan a aparecer los primeros tratamientos dirigidos, más eficacia y menos efectos secundarios para los pacientes.
Las actuales investigaciones en cáncer de mama se dirigen hacia una oncología personalizada y precisa, donde a cada paciente se le pueda aplicar la mejor opción terapéutica según su tipo de cáncer concreto.
Progresión en la investigación contra el cáncer en imágenes:
Proyectos actualmente en desarrollo:
Las nanopartículas como agentes diagnóstico y terapéutico para una radioterapia más eficaz y personalizada
Durante las últimas décadas, la radioterapia ha aumentado sus prestaciones frente a otras técnicas en el tratamiento del cáncer. Esto se ha producido por sí misma, o en combinación con la quimioterapia, la cirugía y/o la inmunoterapia. Gracias a la evolución tecnológica asociada, así como a un mayor concurso de la imagen en la planificación, la precisión de la irradiación ha mejorado considerablemente, colimando el haz con mayor eficacia sobre el tumor, protegiendo a la vez los órganos sanos involucrados. A pesar de este logro, una misma dosis de tratamiento ofrece resultados diferentes sobre cada paciente. La tecnología a nuestra disposición pudiera estar siendo infrautilizada porque prescribimos la dosis y definimos la lesión a tratar basándonos en la experiencia promediada estadísticamente a partir de un mismo tratamiento a una población de pacientes, en lugar de hacerlo de manera más individualizada.
Este proyecto pretende mejorar los resultados de la radioterapia incorporando nanopartículas basadas en un elemento como el oro que, por un lado, permita determinar mejor dónde está la lesión en imagen radiológica a determinadas concentraciones y, por otro, pueda potenciar el efecto de la radiación sobre las células tumorales que captarían estas nanopartículas con mayor avidez que las células sanas. De esta manera, podríamos mejorar el diagnóstico circunscribiendo con mayor precisión dónde está la lesión en cada paciente y además, potenciar el efecto radiobiológico a nivel celular, permitiendo elevar la dosis terapéutica sin miedo a dañar con la radiación los tejidos sanos circundantes.
Búsqueda de indicadores que permitan predecir la eficacia de los tratamientos de inmunoterapia en pacientes de cáncer de mama triple negativo
Las nuevas inmunoterapias han mejorado la eficacia en el tratamiento del cáncer de mama triple-negativo (TNBC). Sin embargo, su mecanismo de acción no se comprende completamente, dificultando la identificación de biomarcadores. Éstos son pruebas que indican qué pacientes responderán a un tratamiento específico. Actualmente, las inmunoterapias carecen de biomarcadores para el TNBC.
Estudios anteriores han analizado la interacción entre las células del sistema inmunitario y las células tumorales en el tumor y la sangre para comprenderlas y definir biomarcadores. Aunque se han generado conocimientos significativos, no se han establecido nuevos biomarcadores. Estos estudios se han centrado en células en estado de reposo.
Las células inmunitarias y tumorales tienen vías de señalización interna que determinan su percepción del entorno y su respuesta a él, tales como detectar proteínas anómalas en la superficie de las células tumorales y reaccionar en consecuencia, eliminándolas. Hemos demostrado previamente que estudiar estas vías en tiempo real proporciona información valiosa sobre el comportamiento celular, más que hacerlo en condiciones de reposo.
Nuestro próximo paso es analizar dinámicamente las principales vías de señalización inmunitaria en células de la sangre y del tumor, antes y después de la exposición a inmunoterapias en pacientes con TNBC. Comprenderemos cómo estas vías se ven afectadas y las correlacionaremos con la respuesta al tratamiento.
Este estudio tiene como objetivo identificar biomarcadores precisos que permitan decisiones terapéuticas personalizadas con inmunoterapias para pacientes con TNBC.
Papel de los mecanismos de reciclaje celular en el desarrollo y prevención del cáncer
Nuestro objetivo es entender cómo podemos usar los mecanismos de reciclaje celular para tratar el cáncer. Sabemos que las células cancerosas aprovechan sus mecanismos de procesamiento de los restos celulares como fuente de energía para multiplicarse, especialmente en tumores sólidos donde el aporte de energía por el riego sanguíneo es escaso. Trabajamos con proteínas que tienen un papel fundamental en coordinar estos procesos de manejo de residuos celulares y buscamos formas de manipular su actividad a modo de tratamiento contra el cáncer. Para ello empleamos técnicas avanzadas de biología molecular que nos ayudarán a dar con compuestos farmacológicos eficientes para frenar el desarrollo de diversos tipos de cáncer.
Adentrándonos en el mundo de la realidad mixta: cirugía radioguiada mediante soporte remoto a kilómetros de distancia
El cáncer de mama es una enfermedad relativamente frecuente en mujeres y que desafortunadamente va en aumento. La detección temprana evitando su propagación a otras partes del cuerpo es fundamental para un tratamiento efectivo. Una técnica asistencial fundamental para el diagnóstico es la biopsia del ganglio centinela que representa la vía por la cual se expandirá el cáncer si no se trata a tiempo. A menudo, encontrar estos ganglios linfáticos puede ser un desafío, aunque gracias a las imágenes prequirúrgicas y a la colaboración de médicos nucleares y cirujanos, se ha desarrollado una técnica de detección y exéresis quirúrgica muy precisa.
Sin embargo, la presencia física del médico nuclear en el quirófano puede ser logísticamente complicada, especialmente en centros que carecen de servicio de Medicina Nuclear. Una solución innovadora radica en la aplicación de la tecnología de realidad mixta para proporcionar asistencia a distancia durante la cirugía. Mediante el uso de gafas que superponen modelos 3D y datos en tiempo real sobre la paciente, los cirujanos pueden recibir instrucciones precisas de expertos en Medicina Nuclear ubicados a kilómetros de distancia. Además, los modelos digitales 3D facilitan la planificación quirúrgica.
El valor añadido que puede suponer la implementación de realidad mixta en la biopsia del ganglio centinela tiene el potencial de revolucionar la cirugía del cáncer de mama por varias razones. No solo permite asistencia remota, mejorando la eficiencia quirúrgica y abordando los desafíos logísticos, sino que también contribuye a la estandarización de los procedimientos en diferentes centros de salud.
Sensibilización del cáncer de mama luminal (ER+) a inmunoterapia
El cáncer de mama luminal es el subtipo más frecuente en mujeres. Este tipo de tumores se caracteriza porque su crecimiento depende de una mayor actividad del receptor de estrógenos (ER). Por tanto, la principal terapia para estas pacientes consiste en bloquear la actividad de este receptor. Sin embargo, hay muchas pacientes que no responden o acaban desarrollando resistencia y por ello, sigue siendo necesaria la búsqueda de nuevos tratamientos.
En este sentido, la inmunoterapia ha emergido como uno de los tratamientos más prometedores para tumores sólidos. Este tratamiento tiene como objetivo activar el sistema inmune para que encuentre y mate a las células cancerosas. Desgraciadamente, esta terapia no ha mostrado ningún beneficio clínico en cáncer de mama ER+. Nuestro objetivo, por tanto, es que las pacientes con este tipo de tumores puedan beneficiarse también de la inmunoterapia.
Para ello, queremos estudiar la acción de LCOR, un factor que regula la expresión (o activación) génica y que normalmente interacciona con ER. En base a nuestros resultados preliminares, creemos que, cuando no se encuentra unido a ER, LCOR puede llevar a cabo otra función: aumentar la visibilidad de las células tumorales y por tanto su reconocimiento y eliminación por parte del sistema inmune. Nuestra idea es encontrar fármacos que modulen la expresión de LCOR, a la vez que bloqueamos los estrógenos, para conseguir que los tumores sean más visibles para el sistema inmune y favorecer así la respuesta a inmunoterapia en pacientes con cáncer de mama ER+.
Estrategia molecular para sensibilizar el cáncer de mama estrógeno positivo a la inmunoterapia
La inmunoterapia incrementa el efecto anti-tumoral del sistema inmune para eliminar las células tumorales. Este tipo de tratamiento ha mostrado grandes beneficios y respuestas duraderas en pacientes con diferentes tipos de cáncer. Sin embargo, el cáncer de mama dependiente de hormonas (cáncer de mama estrógeno positivo – ER+BC) no funciona. Este subtipo de cáncer de mama representa el 70% de todos los casos de cáncer de mama. Nuestro grupo ha descubierto que un gen llamado LCOR que aumenta drásticamente la visibilidad de las células tumorales al sistema inmunológico para que sean eliminadas. Sin embargo, hemos visto como el receptor de estrógenos inhibe esta función de LCOR en el ER+BC pudiendo causar la falta de visibilidad al sistema inmune y por tanto la falta de eficacia de la inmunoterapia. En este proyecto apoyado por la Asociación queremos demostrar que si conseguimos interrumpir la interacción de LCOR con el receptor de estrógenos podemos conseguir una mayor visibilidad al sistema inmune y así respuesta a inmunoterapia en este subtipo de cáncer de mama. Además queremos encontrar moduladores de LCOR para encontrar medicamentos que induzcan LCOR en ER+BC y así poder combinar con inmunoterapia. Sensibilizar el ER+BC a la inmunoterapia representaría un gran hito para los pacientes con cáncer de mama, ya que les daría la oportunidad de utilizar los grandes beneficios de la inmunoterapia en este subtipo mayoritario de cáncer de mama.
Desarrollo de inhibidores de la interacción de dos factores implicados en la reparación del ADN para radio-sensibilizar tumores de mama
BRCA2 es un factor de reparación del ADN que permite reparar las roturas del ADN con alta fidelidad. Su papel es fundamental para evitar la acumulación de mutaciones genéticas y prevenir el cáncer. Entre un 55 y un 85% de las mujeres que presentan una anomalía en BRCA2 desarrollan cáncer de mama durante su vida. La función de BRCA2 depende de su interacción con otros factores. Hemos descubierto una nueva proteína asociada a BRCA2 que podría contribuir a la reparación fiel del ADN. Como esta unión favorece la reparación, hemos hecho un cribado de pequeñas moléculas que interrumpan esta interacción para que la reparación no funcione bien en tumores. Nuestro objetivo es usar estos inhibidores en combinación con quimio o radioterapia para el tratamiento mas efectivo del cáncer de mama.
Nuevas estrategias terapéuticas para evitar resistencia terapias dirigidas e inmunoterapias en cáncer de mama
El cáncer de mama triple negativo (TNBC) es el subtipo de cáncer de mama más agresivo y con peor pronóstico, ya actualmente carece de terapias dirigidas efectivas. Sin embargo, avances recientes ofrecen esperanza para el TNBC con mutaciones en BRCA1 y BRCA2, las cuales se caracterizan por ser deficientes en el proceso de reparación del ADN. En particular, existen nuevas terapias que actúan en el marco de estos procesos moleculares, como los nuevos inhibidores de la enzima PARP (PARPi) y la inmunoterapia, aunque en un número importante de pacientes se observa la aparición de resistencia a estos tratamientos. Nuestro proyecto se basa en la restitución in vitro de la proteína de membrana en células de TNBC, con el fin de aumentar la eficiencia y revertir la resistencia a los inhibidores de PARP, una de las principales limitaciones en el uso de terapias dirigidas. Con el objetivo de avanzar hacia su aplicación en la clínica, este proyecto aspira a optimizar este enfoque terapéutico, basado en el uso de nanovesículas lipídicas restaurar la actividad de esta proteína en membrana y en combinación PARPi e inmunoterapias basadas en el uso de inhibidores de puntos de control inmunológico, con el fin de incrementar la eficacia de estas terapias y evitar el desarrollo de resistencias.
Desarrollo de tratamientos para vencer la resistencia a radioterapia en el cáncer de mama triple negativo (TNBC)
Las pacientes con cáncer de mama triple negativo (TNBC) que no responden de manera óptima tras el tratamiento inicial de quimioterapia presentan tasas de recaída locorregional que oscilan entre el 10 y 25% de los casos a pesar de el tratamiento de cirugía y radioterapia que sigue a la quimioterapia. En estas pacientes el tumor re-emerge en la mama intervenida (y/o ganglios regionales). En estas condiciones las opciones terapéuticas son bajas y se asocian con un mal pronóstico. Desde el punto de vista clínico supone un reto el descubrir nuevas dianas que puedan dar lugar a tratamientos más eficaces para erradicar este problema.
En una estudio previo realizado gracias también al apoyo de Asociación Española Contra el Cáncer hemos identificado la molécula Enpp1 (CD203a) como una nueva diana terapéutica en TNBC. Este gen funciona dotando a las células tumorales de capacidad para neutralizar a las células atacantes del sistema inmune creando así un ambiente inmunosupresor que favorece el crecimiento de la recidiva local. Su inhibición farmacológica conlleva una disminución ostentosa de las recidivas locales en modelos animales de cáncer de mama.
Basados en estos estudios pretendemos profundizar en los mecanismos mediados por Enpp1 en combinación con la radioterapia. También procederemos a la búsqueda en pacientes con TNBC de un nuevo biomarcador señuelo de Enpp1 que hemos identificado y finalmente realizar un ensayo clínico en pacientes que cumplan una serie de requisitos para evaluar la eficacia terapéutica del inhibidor de Enpp1 junto con la radioterapia convencional que se utiliza hasta ahora.
Nuevas estrategias de radioinmunoterapia para tumores sólidos
La radioterapia se ha usado con éxito en el tratamiento de cáncer de mama. Pero debido a ciertos mecanismos del sistema inmunitario implementados por el tumor, la radioterapia rara vez produce una respuesta sistémica de la enfermedad metastásica localizada fuera del campo de irradiación (efecto abscopal). Hay resultados clínicos y preclínicos donde apuntan que la combinación de radioterapia junto con un tipo de inmunoterapia (inhibidores de los puntos de control o “immune checkpoints”) favorecen respuestas sistémicas. Actualmente el efecto abscopal continúa siendo un fenómeno anecdótico en la clínica. Por lo tanto, es importante descifrar los mecanismos subyacentes de resistencia a las combinaciones de radioinmunoterapia para identificar estrategias que los mejoren. Por ese motivo, con la hipótesis de que la radioterapia sinergiza con la inmunoterapia, proponemos una nueva inmunoterapia intratumoral basada en agonista de TLR3 (BO-112) en combinación con otras inmunoterapias y radioterapia en ratones con tumores de mama multifocales. En paralelo, se está llevando en la cínica un ensayo clínico fase 1/2 (NCT05265650) para pacientes con cáncer de pulmón refractarios a inmunoterapia basado en la combinación de radioinmunoterapia del estudio. Por lo tanto, los resultados de este proyecto ayudarán a mejorar el tratamiento actual en pacientes y guiarán el desarrollo de diseños racionales de ensayos clínicos de radioinmunoterapia.
Desarrollo de una terapia de sensibilización a la respuesta inmune antitumoral promovida por radioterapia para reducir el riesgo de recaída
La radioterapia es uno de los principales tratamientos en los pacientes oncológicos. Principalmente tiene dos mecanismos de acción, uno directo que implica la eliminación de las células tumorales bajo el campo irradiado, y otro indirecto, que consiste en la generación de un proceso de vacunación natural antitumoral in situ en la lesión tumoral irradiada. Se genera una respuesta inmune frente a una serie de moléculas únicas especifica e identitarias del tumor, lo que se conoce como neoantígenos. Este proceso de vacunación si fuese optimo ayudaría a mantener controlada la diseminación de la enfermedad y evitar procesos de metástasis. Sin embargo, en muchos casos este proceso de vacunación endógeno no es eficaz y muchos pacientes recaen. Creemos que esto puede ser debido en gran medida a que durante la radioterapia también se genera un fenómeno inflamatorio sistémico que puede ser detectado por las células tumorales residuales que no han sucumbido a la acción de la radioterapia. Esta señal inflamatoria detectada por células tumorales activa un proceso que las protege de la acción del sistema inmune, en particular alterando la identidad inmune (neoantígenos) contra los que se había generado el proceso de vacunación endógeno. Con la ayuda de la financiación de la AECC pretendemos dilucidar los mecanismos inmunes que subyacen a este proceso de escape y desarrollar una terapia dirigida específica para contrarrestarlo.
Estudio de la maquinaria que regula el acceso a la información genética, y su relevancia en cáncer
Mi proyecto se centra en el estudio de la maquinaria encargada de regular el acceso a la información genética, o ADN, es decir, el libro de instrucciones de las células. La información genética tiene que estar accesible en momentos clave, como cuando las células se dividen o reparan errores. El mal funcionamiento de la maquinaria que regula esto se relaciona con distintos tipos de cáncer, entre ellos mama, ovario, colon y próstata. Sin embargo, aunque hay una conexión clara entre la ausencia o el mal funcionamiento de esta maquinaria y distintos procesos tumorales, se desconocen los detalles. La principal razón es que prácticamente no existe información de la arquitectura o estructura de esta maquinaria, en concreto cómo se unen los distintos componentes, cómo actúan sobre el ADN y cómo se regulan. Por eso, el objetivo general de este proyecto de investigación básica es entender, a través de su arquitectura, cómo funciona esta maquinaria y cómo se regula, utilizando la microscopía electrónica. Conociendo en detalle la estructura de esta maquinaria podremos localizar con precisión los defectos relacionados con el desarrollo de cáncer y entenderemos por qué se producen. Este conocimiento pondrá las bases para una investigación más aplicada, en la que se tratará de reparar o suplir estos defectos. En conjunto esto permitirá, en un futuro, abrir posibilidades terapéuticas completamente nuevas.
Investigar el papel de quinasas durante la división celular y su desregulación en cáncer de mama
El cáncer es una de las enfermedades con mayor mortalidad en el todo el mundo, siendo el de mama el más frecuentemente diagnosticado. La progresión de la división celular es controlada por un conjunto de proteínas entre las que se encuentran las denominadas quinasas, mientras que la orientación depende de una maquinaria que controla el plano de división. A lo largo de los años se ha estudiado el papel de estas quinasas en cáncer, ya que sus defectos llevan a inestabilidad cromosómica. La posición que adquieren las células tras la división es primordial tanto para mantener la arquitectura y renovación de tejidos como para el desarrollo y la generación de órganos. Por lo tanto, una orientación errónea lleva a la formación de tumores por generación de inestabilidad genética y desorganización de tejidos y órganos. Aunque los mecanismos que controlan esta orientación han sido extensamente estudiados, aun es necesario seguir avanzando para lograr desenmascarar las señales moleculares responsables de estos procesos. El objetivo de este proyecto es investigar el papel de las principales quinasas en la división y como su desregulación puede conllevar a la formación de tumores. Se utilizarán técnicas de edición del genoma, proteómica, bioquímica y biología celular además de microscopia. Como organismos se utilizarán células de mamífero y cultivos en 3D, además se analizarán muestras humanas procedentes de tumores de mama. El conocimiento adquirido ayudará a comprender los mecanismos que subyacen a importantes enfermedades humanas como el cáncer.
Esclareciendo cómo las metástasis cerebrales interactúan con los circuitos neuronales para entender el origen de los trastornos neurocognitivos en pacientes
Casi la mitad de los pacientes con metástasis cerebral sufren trastornos neurocognitivos que van desde pérdidas de memoria hasta dificultades para desarrollar actividades cotidianas como conducir o tomar la medicación y obviamente, este aspecto tiene un terrible impacto sobre sus calidades de vida. Sorprendentemente, nuestro conocimiento sobre cuáles son los aspectos moleculares tras esta influencia negativa de la metástasis sobre el circuito neuronal es, literalmente, inexistente. Hasta ahora, se pensaba que el crecimiento del tumor presionaba el tejido cerebral provocando una muerte neuronal que era la causante de la aparición de estos trastornos. Sin embargo, teniendo en cuenta los limitados estudios clínicos realizados en esta materia, parece ser que este “efecto de masa” no es suficiente para explicar por qué algunos pacientes sí tienen un trastorno neurocognitivo cuando otros no lo tienen.
Nuestro objetivo en este proyecto es esclarecer cómo las metástasis cerebrales interactúan con los circuitos neuronales para así poder entender el origen de los trastornos neurocognitivos en pacientes con metástasis cerebral. Para ello, llevaremos a cabo en el laboratorio una serie de técnicas como por ejemplo la electrofisiología para medir la actividad neuronal o ingeniería genética para identificar posibles moléculas candidatas. Llevando a cabo estas técnicas entre otras muchas, esperamos encontrar una nueva colección de estrategias terapéuticas que nos permitan aliviar o incluso prevenir el efecto negativo que ejerce la metástasis cerebral sobre la calidad de vida de los pacientes, protegiendo la función cerebral de la influencia del tumor.
Biopsia líquida en el cáncer de mama metastásico para una medicina personalizada
El cáncer de mama es la primera causa de muerte relacionada con el cáncer en mujeres en España, lo que revela el impacto social y económico de la enfermedad. Particularmente, en el cáncer de mama luminal, cuando la metástasis es detectada, la tasa de supervivencia a 5 años es alrededor del 32% y a pesar de las mejoras realizadas en la última década en prevención, diagnóstico, y tratamiento, la enfermedad metastásica sigue siendo difícil de tratar. Esto se debe principalmente a la capacidad que tienen algunas células tumorales de adaptarse a los tratamientos gracias a cambios moleculares que sufren. Por lo tanto, un reto importante es desarrollar nuevas estrategias personalizadas para evaluar y mejorar la respuesta del tumor al tratamiento, así como mejorar los propios tratamientos, y por lo tanto la supervivencia de las pacientes.
Para este desarrollo es necesario entender los mecanismos moleculares de adaptación del tumor y así identificar marcadores de pronóstico y predictivos que guíen a los oncólogos durante el tratamiento. Este proyecto plantea identificar dichos mecanismos a través del estudio genético de las células tumorales circulantes (CTC) y del ADN tumoral circulante, liberados por el tumor a la circulación sanguínea, mediante técnicas de biopsia líquida. Nuestro objetivo es utilizar este conocimiento para ayudar a la toma de decisiones terapéuticas que permitan una intervención más personalizada que mejore significativamente el manejo y supervivencia de las pacientes con cáncer de mama luminal metastásico.
La bestia durmiente: entendiendo cómo las células cancerosas duermen en nuevas zonas metastásicas
A pesar del éxito de la resección y el tratamiento del tumor primario, es frecuente que las pacientes con cáncer de mama sufran metástasis en otros órganos incluso años después del diagnóstico inicial. Esto lo provocan algunas células cancerosas que resisten los tratamientos y viajan por el torrente sanguíneo o el sistema linfático hasta otros órganos. En el caso del cáncer de mama, el destino más común de estas células es el hueso. Una vez que llegan a la nueva zona, estas células entran en un estado "durmiente" llamado latencia, en el que dejan de dividirse, lo que dificulta su detección y, por tanto, su tratamiento. Luego, pueden despertar de repente, generando el nuevo tumor. El proceso de "dormir" y "despertar" no es del todo conocido por la comunidad científica, pero se sugiere que el microambiente celular (en este caso la el de la médula ósea, por ejemplo), podría impulsar estos procesos. El objetivo de este proyecto es imitar el microentorno de estas células durmientes con modelos bioinspirados en 3D y tratar de explicar sus mecanismos de (des)activación. De este modo, podrían desarrollarse nuevas estrategias terapéuticas dirigidas específicamente a estas células que ahora son difíciles de detectar y tratar.
Ensayo clínico en fase I de un tratamiento para el cáncer de mama HER2+
Las pacientes de cáncer de mama HER2 positivo, en las que ya no funcionan los medicamentos actualmente disponibles (p.e. trastuzumab), tienen mal pronóstico. Nosotros hemos diseñado un nuevo producto de terapia celular personalizado (ARI-HER2) que creemos que podría ser eficaz en estas pacientes sin opciones de tratamiento, consistente en la reprogramación genética del sistema inmune de la propia paciente. Los experimentos realizados en el laboratorio confirman la escasa toxicidad del producto y una potencial eficacia en estas pacientes sin opciones terapéuticas. Para demostrarlo, planteamos un ensayo clínico en tres instituciones españolas (Fundació Clínic per a la Recerca Biomèdica-IDIBAPS, Hospital Universitario 12 de Octubre y Clínica Universidad de Navarra) en el que probaremos diferentes dosis del producto y así podremos establecer la dosis más adecuada para continuar con este desarrollo. La Agencia Española de Medicamentos y Productos Sanitarios ya ha dado el visto bueno al desarrollo de este producto. Además, nuestra institución ya ha desarrollado 3 productos más de similares características (ARI-0001, ARI0002h y ARI-0003) con los que hemos tratado a más de 200 pacientes con leucemia, linfoma y mieloma, lo que da fe de nuestra capacidad para conseguir estos objetivos.
Desarrollo de nuevas herramientas para mejorar las terapias de protonterapia en cáncer
La protonterapia es un tipo de radioterapia externa que utiliza protones en lugar de fotones de rayos X para tratar el cáncer. A diferencia de la radioterapia convencional, un haz de protones tiene la capacidad de depositar su energía en un volumen muy específico, alcanzando al tumor con mucha más precisión. Esta propiedad de los protones supone una ventaja significativa ya que permite minimizar la dosis de radiación recibida por los tejidos sanos adyacentes al tumor, lo que se traduce en una disminución significativa en la probabilidad de efectos secundarios a largo plazo. Esta "puntería" la convierte en una técnica especialmente indicada para tratar tumores que se encuentran cercanos a órganos radiosensibles como ocurre con el cáncer pediátrico, de próstata o próximo al sistema nervioso; siendo precisamente en el tratamiento de estos tipos de cáncer donde esta investigación espera poder contribuir.
Sin embargo, actualmente carecemos de un modo preciso de medir el rango de penetración del haz de protones y dónde se detiene completamente, limitando la utilización óptima del tratamiento. Mi trabajo consistirá en el desarrollo de una tecnología específica basada en carburo de silicio (un resistente material semiconductor) que permita medir el perfil de deposición de energía del haz de manera precisa hasta su deposición completa para confirmar la no interacción con las células sanas que estamos tratando de preservar. La investigación se desarrollará principalmente en el Hospital Marqués de Valdecilla, pero con el claro objetivo de expandir cualquier resultado exitoso al resto de centros españoles e incluso internacionales.
Redirección del sistema inmune para luchar contra el cáncer de mama
Nuestra propuesta busca mejorar la seguridad y la eficacia de una terapia innovadora para tratar el cáncer en aquellos pacientes que presentan altos niveles de la proteína HER2. Aunque esta proteína se encuentra en tejidos sanos en cantidades reducidas, su sobreproducción causa aproximadamente un 4 % de todos los cánceres y 20% de los de mama y gástricos.
Previamente, hemos modificado linfocitos T de pacientes oncológicos para que ataquen sus células tumorales, una tecnología llamada "células CAR T". Utilizando estas células junto a anticuerpos que refuerzan la actividad de los linfocitos T al reconocer la proteína HER2, hemos mejorado la respuesta inmune antitumoral del paciente, creando una terapia nueva que ataca a los tumores y minimiza la posibilidad de recaídas. Sin embargo, observamos algunos efectos secundarios potencialmente tóxicos para los tejidos sanos.
Nuestro actual objetivo es reducir estos efectos adversos, ajustando la capacidad de nuestras CAR Ts para reconocer a la proteína HER2 únicamente en células tumorales, evitando así una respuesta autoinmune y manteniendo la eficacia terapéutica. Para ello, modificaremos los anticuerpos activadores para disminuir su afinidad por la proteína HER2, reduciendo los efectos tóxicos no deseados. Nuestro plan se divide en tres fases:
1. Analizar el funcionamiento de nuestra terapia y su funcionamiento en el laboratorio sobre células en cultivo.
2. Probar la seguridad y eficacia de nuestra terapia en modelos de ratones con tumores derivados de células de cáncer de mama.
3. Evaluar el efecto terapéutico en modelos de ratones con tumores derivados directamente de pacientes.
Identificación de mecanismos de resistencia a quimioterapia en cáncer de mama triple negativo
El cáncer de mama es el más diagnosticado y la segunda causa de muerte por cáncer en mujeres. A pesar de los exitosos avances en investigación y clínica oncológica, el cáncer de mama triple negativo continúa siendo un desafío para la medicina. Únicamente la quimioterapia con taxanos y antraciclinas ha demostrado ser efectiva contra el cáncer de mama triple negativo, con solo un 50% de supervivencia. Muchos de los pacientes desarrollan resistencia al tratamiento y la recurrencia del cáncer. Una de las características que lo hacen tan agresivo es su heterogeneidad, es decir, el estar formado por muchas células (o clones) tumorales diferentes. Una mayor heterogeneidad facilita que alguno de los clones sobrevivan al tratamiento y el tumor reaparezca. El objetivo de este proyecto es entender cómo estos tumores desarrollan quimio-resistencia, con el fin de proponer nuevas dianas terapéuticas y mejorar la supervivencia de los pacientes. Para ello, colaboramos con el grupo de Drs. Juan Miguel Cejalvo y Ana Lluch del INCLIVA que nos proporcionarán muestras de tumores de 40 pacientes de cáncer de mama triple negativo antes y después del tratamiento. Utilizaremos técnicas punteras de secuenciación de célula única para tratar de identificar cambios a nivel celular y molecular en los tumores en respuesta al tratamiento. El poder analizar célula a célula nos permitirá ver qué clones han sobrevivido a la quimioterapia y qué los diferencia de los vulnerables. Las nuevas dianas terapéuticas propuestas serán validadas en ratones por el grupo de Dr. Ángel Nebreda del IRB.
Aplicación de inteligencia artificial para predecir el tratamiento personalizado en cáncer de mama triple negativo
El cáncer de mama triple negativo (TNBC) representa el 10-20% de todos los cánceres de mama, y suele ser más frecuente en mujeres menores de 40 años. Este tipo de cáncer tiende a crecer y extenderse más rápidamente, tiene menos opciones de tratamiento y las tasas de recaída o fallecimiento son más altas. A pesar de los esfuerzos por descubrir nuevas dianas terapéuticas, el 40% de las pacientes en estadios 1 a 3 sufrirán una recaída y la probabilidad de supervivencia a 5 años es del 65%, frente al 86% de media en el cáncer de mama global. La heterogeneidad del cáncer de mama triple negativo juega un papel decisivo en estos fracasos terapéuticos, haciendo necesaria la implementación de una oncomedicina más precisa y personalizada.
Este proyecto está destinado a:
- Identificar perfiles moleculares y celulares de estos tumores gracias a estudios multiómicos, que son análisis de múltiples datos biológicos (genes, proteínas expresadas, sustancias secretadas por las células, presencia de células inmunitarias en el tumor)
- Correlacionarlos con la respuesta a distintos tratamientos terapéuticos mediante ensayos preclínicos.
De esta manera podremos identificar el tratamiento más adecuado para cada tipo perfil de cáncer de mama triple negativo identificado. Todos los resultados obtenidos serán procesados mediante inteligencia artificial para crear una herramienta informática (software). Este software permitirá a los hospitales identificar el tratamiento adecuado para cada paciente de cáncer de mama triple negativo en función de su perfil molecular y celular.
Nuevas estrategias terapéuticas basadas en nanotecnología para el tratamiento de tumores agresivos
Aunque comúnmente se conoce al cáncer como una única enfermedad, existen muchos tipos de cáncer. De hecho, incluso un cáncer concreto, como el cáncer de mama, puede tener diferentes subtipos según las características del tumor. Es el caso del cáncer de mama triple negativo, un subtipo que se caracteriza por su agresividad, su aparición, principalmente en mujeres jóvenes, y la ausencia de un tratamiento específico. Otro tipo tumoral muy agresivo es el glioblastoma, un tumor cerebral que, si bien no es tan frecuente como el cáncer de mama, tiene otras características más complejas. Por ejemplo, la accesibilidad al tumor y la corta esperanza de vida de los pacientes, que no supera los 15 meses de media desde el diagnóstico. Además, los tratamientos utilizados contra estos tipos tumorales son muy generales y tienen muchos efectos secundarios. Por tanto, para ambos tipos tumorales se hace necesario explorar tanto nuevos tratamientos como nuevas estrategias terapéuticas que permitan una llegada más eficiente al tumor.
Bajo esta premisa, buscamos atacar las células tumorales con un fármaco que destruya proteínas que ayudan a éstas a sobrevivir. Además, este fármaco no se suministrará libre, sino que estará envuelto en nanopartículas de sílice nanoporosas, capaces de almacenar gran cantidad de fármaco, de manera que la liberación del fármaco será más controlada.
El subtipo basal: un mismo tipo de cáncer en diferentes órganos
Generalmente cuando hablamos del cáncer, nos referimos a él según el órgano en el que se origina: cáncer de mama, de colon, de ovario, de vejiga, etc. Pues bien, todos estos tumores podrían tener características más parecidas de lo que pensamos. Al fin y al cabo, todos estos órganos son tejidos del cuerpo humano que tienen una estructura similar.
En nuestro proyecto vamos a estudiar un subtipo de cáncer llamado subtipo basal, que es muy conocido en el cáncer de mama y que se caracteriza porque son tumores agresivos y con una mala supervivencia. El nombre de “subtipo basal” se le ha dado porque estos tumores tienen características que recuerdan a las células basales, que son las que se sitúan en la base de los tejidos.
Nosotros vamos a tratar de identificar el subtipo basal en tumores de otros órganos. Estudiaremos sus características con modernas técnicas de biología molecular con el objetivo de encontrar similitudes entre ellos a pesar de tener orígenes distintos. Esto es importante porque significa que tumores que surgen de distintos órganos pueden tener características moleculares similares y podrían ser tratados con una misma terapia o tener el mismo pronóstico para los pacientes.
El papel de AXL y el microentorno tumoral en la resistencia a agentes anti-HER2 en cáncer de mama
El cáncer de mama no está formado sólo por células cancerosas, sino también por otros tipos de células que provocan alteraciones en el microentorno tumoral (es decir las células sanas que rodean al tumor). Estas alteraciones son cruciales para el desarrollo y la progresión del cáncer de mama, y también representan una nueva diana terapéutica (es decir, un punto débil al que poder dirigir nuevos fármacos).
Existen diferentes componentes del microambiente que actúan conjuntamente para impedir una respuesta antitumoral y promover la progresión y metástasis. El microambiente se caracteriza por alteraciones moleculares y vías de señalización aberrantes. Actualmente, existen diferentes tratamientos dirigidos a los componentes del estroma (el tejido que rodea los órganos) en desarrollo en ensayos clínicos.
En este proyecto se estudiará la composición del microambiente tumoral, sus alteraciones moleculares y la interacción entre las células tumorales y los diferentes componentes del microambiente. El objetivo del proyecto es comprender el papel de la transición epitelio-mesénquima y del microambiente tumoral como mecanismo de resistencia a los agentes anti-HER2 en el cáncer de mama HER2+. En este contexto, proponemos la molécula AXL como biomarcador potencial de resistencia en pacientes con cáncer de mama HER2+. AXL está implicado en múltiples etapas del cáncer. Además, la sobreexpresión (sobreproducción) de AXL se ha asociado con un mal pronóstico clínico en diferentes tumores.
Cómo potenciar los tratamientos de inmunoterapia contra el cáncer modulando las células del sistema inmunitario y la obtención de lípidos
La inmunoterapia ha revolucionado el tratamiento contra el cáncer, sin embargo todavía no es del todo efectiva en la totalidad de los pacientes. La eficacia de la inmunoterapia depende de la presencia de un tipo de célula del sistema inmunitario llamadas linfocitos T en tumores, y de la actividad de los macrófagos, otras células del sistema inmunitario.
En nuestras investigaciones hemos descubierto que la presencia de un tipo muy concreto de macrófagos (macrófagos que están cargados de lípidos) favorecen la progresión del tumor y la resistencia al tratamiento con inmunoterapia. Nuestro proyecto se centra en encontrar formas de impedir que estos macrófagos "fagociten" lípidos, con el fin de favorecer la respuesta de la inmunoterapia, y esto lo vamos a hacer con varias aproximaciones, entre ellas modificando nuestra dieta.
Mecanismos dinámicos de adaptación en la biología de la metástasis
El cáncer de mama puede ser mortal si se extiende a lugares secundarios, sobre todo si hay varios órganos afectados. Pruebas recientes sugieren que la mayoría de las metástasis en órganos distantes se generan desde la metástasis ósea, en lugar del tumor primario. En este proyecto planteamos la hipótesis de que la plasticidad celular, que se genera por mecanismos de adaptación no relacionados con cambios en el ADN, facilita la metástasis ósea primaria, la metástasis secundaria a nuevos órganos y la resistencia a los fármacos, lo que da lugar a una baja supervivencia de los pacientes.
Nuestro objetivo es entender las redes moleculares que dan forma a los estados de adaptación. Integraremos datos de distintos modelos de cáncer de mama con muestras clínicas de pacientes de diferentes estados metastásicos para revelar el orden secuencial de los acontecimientos. Este conocimiento de los factores que facilitan la metástasis nos dará las herramientas para prevenir la propagación letal a otros órganos y la resistencia a los tratamientos.
Resultados destacados:
Identificación de nuevos biomarcadores para el desarrollo de terapias dirigidas contra el cáncer de mama (CALIBRATE)
¿Cómo eliminar las células tumorales con alto nivel de inestabilidad cromosómica sin afectar a las sanas?
La investigación contra el cáncer está cada vez más focalizada en estrategias terapéuticas individualizadas. Sabemos que las células tumorales usan el metabolismo de las células sanas para su propio beneficio y que son capaces de sobrevivir con altos niveles de inestabilidad cromosómica. Pero esas células también tienen sus límites de tolerancia de inestabilidad cromosómica.
La idea central del proyecto CALIBRATE es identificar combinaciones de compuestos que promuevan aún más la inestabilidad de las células tumorales y con ello provoquen la muerte celular. Causar más daño cromosómico puede parecer contradictorio, pero el proyecto CALIBRATE ofrece la oportunidad de probar esta nueva estrategia para inhibir la formación y la progresión de tumores, especialmente en células de cáncer de mama con un alto nivel intrínseco de inestabilidad cromosómica.
Recientemente hemos caracterizado un nuevo biomarcador de inestabilidad cromosómica, el núcleo toroidal (núcleo con morfología atípica), y hemos identificado una nueva función de la autofagia (proceso catabólico imprescindible para la supervivencia de nuestras células) en la división celular.
Nuestro proyecto de alto riesgo/alto beneficio tiene como objetivo evaluar el nivel intrínseco de inestabilidad cromosómica en los 4 subtipos de cáncer de mama existentes incorporando nuestro exclusivo biomarcador de inestabilidad cromosómica y diseñar terapias innovadoras combinando inhibidores de la autofagia con los tratamientos terapéuticos que están actualmente en uso en modelos preclínicos de cáncer de mama.
Prueba de concepto para nuevas inmunoterapias contra el cáncer basadas en bacterias muertas
La inmunoterapia es un tipo de tratamiento contra el cáncer mediante el cual se intenta activar a nuestro sistema inmune, a “nuestras propias defensas”, contra el cáncer. Esas defensas se dividen en dos, innatas y adaptativas. Las innatas son las primeras en actuar y a su vez, activan a las adaptativas, que son muy eficaces contra el crecimiento tumoral. Este proyecto estudiará si la activación del sistema inmune innato, con ciertas preparaciones hechas a base de bacterias muertas, representa una nueva inmunoterapia contra el cáncer.
¿Por qué y cómo lo haremos? Recientemente se ha descubierto que las células innatas pueden “entrenarse”, con lo que son capaces de responder mejor, llegando a reducir el tamaño de tumores en ratones. Curiosamente, los compuestos que conocemos hasta ahora capaces de inducir este entrenamiento proceden de hongos, o son vacunas utilizadas contra bacterias. Aunque estos inductores de entrenamiento son eficaces, su gran tamaño o que se trata de vacunas “vivas” hace que sea difícil su utilización clínica.
Ante estos inconvenientes, estamos estudiando agentes alternativos capaces de inducir entrenamiento frente a tumores. Datos previos de nuestro laboratorio muestran que determinadas preparaciones de bacterias muertas también entrenan, y sabemos que estas preparaciones son seguras. Lo que buscamos en el presente proyecto es establecer si el tratamiento con estas preparaciones de bacterias muertas logra proteger frente al desarrollo de tumores. Esto supondrían un nuevo tipo de inmunoterapia contra el cáncer que podría utilizarse sola o combinada con los tratamientos actuales.
La radioterapia para el cáncer de mama oligometastásico: monitorización del tratamiento con imágenes y marcadores en sangre
En el cáncer de mama, las metástasis siguen siendo el principal obstáculo para lograr la curación. Cuando las metástasis son pocas, el estadio es menos agresivo, y permite el abordaje mediante radiocirugía. Esta técnica de radioterapia (llamada radioterapia estereotáctica ablativa, SABR) emite altas dosis de radiación en localizaciones muy concretas para proteger los tejidos sanos y eliminar los tumores. Estudios preliminares han observado que es un tratamiento con capacidad curativa, pero aún se desconoce su toxicidad, el perfil de las pacientes que son receptivas al tratamiento y el de las que no.
Nuestra hipótesis es que, mediante imágenes médicas, como las obtenidas por resonancias, PETs y TACs, y análisis de un amplio rango de moléculas sanguíneas seleccionadas, podremos monitorizar la respuesta al tratamiento. Estos análisis generan una gran cantidad de datos, que trataremos con algoritmos de inteligencia artificial para poder seleccionar qué características de las pacientes (tanto clínicas, como de las imágenes y de las moléculas sanguíneas) son las determinantes para poder predecir la respuesta al tratamiento. En este contexto, esperamos obtener información que permita personalizar el tratamiento, de manera que se optimice, y se mejore la calidad de vida y la supervivencia de las pacientes.
Papel de los fibroblastos asociados a tumor en la metástasis a pulmón del cáncer de mama: nuevas oportunidades terapéuticas
La metástasis tumoral es la principal causa de muerte en cáncer de mama. Durante las últimas décadas, la investigación del cáncer de mama ha dejado de abordarse desde una visión reduccionista, focalizada únicamente en las propiedades de las células tumorales, para dar lugar a una visión más colectiva, entendiendo los tumores como pequeños ecosistemas, formados por una gran diversidad de tipos celulares, como por ejemplo los fibroblastos.
De esta manera, las células tumorales establecen comunicación con su entorno, el microambiente tumoral, tanto en el órgano primario donde se originan, como en los órganos secundarios donde metastatizan. Estas interacciones tienen lugar de manera bidireccional, con el fin de promover la resistencia quimioterapéutica, favoreciendo su supervivencia, y como consecuencia dando lugar a la progresión de la enfermedad.
Con un doble enfoque, nuestro objetivo es por un lado definir cómo los fibroblastos favorecen la diseminación de las células de cáncer de mama des del tumor primario, y por otro lado, como los fibroblastos del pulmón favorecen su colonización y supervivencia en el órgano secundario.
En nuestros hallazgos recientes hemos sido capaces de definir una nueva vía de comunicación entre las células de cáncer de mama y los fibroblastos, responsable de la resistencia a terapias dirigidas y con valor predictivo de respuesta en pacientes. A lo largo de este proyecto, nos centraremos en estudiar el papel de estas dianas, en las diferentes etapas claves del proceso metastático: invasión, supervivencia en circulación, diseminación y colonización del órgano secundario.
Monitorización de agentes quimioterapéuticos a tiempo real directamente en el organismo mediante el uso de sensores electroquímicos basados en aptámeros
Los tratamientos quimioterapéuticos contra el cáncer suelen presentar problemas de falta de eficacia, así como graves efectos secundarios que afectan considerablemente la calidad y la esperanza de vida de los pacientes. Esto, en gran medida, se debe a la falta de herramientas analíticas que permitan llevar a cabo un seguimiento continuo y a tiempo real de dicho tratamiento.
Este proyecto tiene como objetivo el desarrollo de sensores electroquímicos para la monitorización de los tratamientos farmacológicos directamente en el cuerpo del paciente. Para ello se utilizarán moléculas de ADN de pequeño tamaño llamadas aptámeros como elementos de reconocimiento. Estos aptámeros son capaces de unirse de manera rápida, selectiva y reversible a la molécula diana, lo que permite obtener medidas en continuo y a tiempo real. Con esta herramienta de monitorización se podrá obtener información precisa de la respuesta del paciente a la quimioterapia y así ajustar la dosis de los fármacos, todo ello a tiempo real. Esto aumentará la eficacia de los tratamientos oncológicos y limitará la aparición de efectos adversos.
Neuronas en el cáncer de mama (NeuroMama): las nuevas influencers a tener en cuenta en la lucha contra el cáncer
Las células cancerosas tienen la capacidad de interaccionar con los diferentes tipos celulares que se encuentran a su alrededor, como son las neuronas del sistema nervioso. Las interacciones con las neuronas garantizan al cáncer su crecimiento, las ayudan a escapar del sistema inmune, y a sobrevivir en entornos hostiles.
Aunque se sabe que las neuronas que están asociadas a tumores tienen un papel muy importante para la progresión tumoral, no sabemos cuáles son los mecanismos que usa el cáncer para poner el sistema nervioso a su favor.
Por ello, en este proyecto subvencionado por la AECC, estamos desarrollando nuevas herramientas de modificación génica y de imagen que nos ayudan a entender cómo interaccionan las neuronas y las células tumorales de los cánceres de mama más agresivos. De este modo, podremos entender cómo las neuronas guían el cáncer de mama desde la iniciación, a la diseminación y finalmente hasta la metástasis.
Además, investigaremos qué herramientas utilizan las neuronas para ayudar a las células tumorales a generar resistencia frente a los tratamientos clínicos vigentes, así como a su posterior recurrencia.
En resumen, el objetivo principal de este proyecto es descifrar el papel que desempeñan las neuronas en la progresión del cáncer de mama, para así poder mejorar su diagnóstico y tratamiento.
Nueva perspectiva en la prescripción y control del entrenamiento de fuerza en supervivientes de cáncer de mama
Este proyecto tiene como objetivo principal optimizar la prescripción y control del entrenamiento de fuerza en mujeres supervivientes de cáncer de mama. Este objetivo se completará analizando la relación carga-velocidad en varios ejercicios habituales que realizan personas que han padecido cáncer de mama, tales como prensa de piernas, remo bilateral, media sentadilla con apoyo, o press de banca, así como desarrollando ecuaciones de regresión que permitan estimar la 1RM (la fuerza dinámica máxima de la persona) en estos ejercicios sin necesidad de que la persona tenga que hacer una prueba máxima. Finalmente, se desarrollará una aplicación móvil que incluya de forma muy intuitiva todo este conocimiento generado para que todos los profesionales que trabajen con personas que han superado un cáncer de mama, incluyendo profesionales del ejercicio, fisioterapeutas, médicos deportivos, y otros profesionales de la salud, tengan acceso a esta sencilla forma de controlar la intensidad del entrenamiento.
Estudio de los mecanismos moleculares de inmunosupresión en los cánceres de mama triple negativos
El proyecto titulado "Estudio de los mecanismos moleculares de inmunosupresión en los cánceres de mama triple negativos", pretende estudiar el potencial terapéutico de una nueva terapia dirigida en pacientes de cáncer de mama triple negativo que responden mal a la quimioterapia neoadyuvante (previa a la cirugía).
Los cánceres de mama triple negativos son un grupo de cánceres que, por no expresar ninguno de los tres receptores más habituales, no se pueden tratar con terapias dirigidas contra ellos. Por eso suelen tener peor pronóstico. Actualmente, el tratamiento para el cáncer de mama triple negativo se basa en la quimioterapia neoadyuvante. A pesar de que el 36% de las pacientes responden positivamente al tratamiento, la mayoría no responden y presentan peor pronóstico. De ahí surge la necesidad de buscar nuevas terapias alternativas más eficaces.
Recientemente, hemos descubierto que las pacientes que responden mal a esta terapia tienen perfiles de inmunosupresión, es decir, tienen apagado el sistema inmune. Estos perfiles de inmunosupresión se han relacionado con baja expresión del gen KDM6A. Por eso, queremos examinar el papel dicho gen en este grupo de pacientes, así como estudiar el efecto de la inhibición farmacológica de sus reguladores negativos.
Estudio de nuevos fármacos antitumorales
Hace aproximadamente un siglo, se descubrió que las células tumorales sufren un cambio metabólico mediante el cual utilizan la glucosa como fuente energética de manera distinta al resto de células. Esta forma de usar la glucosa se denomina fermentación y aunque genera menos energía que el proceso que utilizan las células sanas, favorece el crecimiento del tumor. Mediante este proceso las células tumorales generan señales que favorecen la formación de vasos sanguíneos, una mayor proliferación de las células o la migración de estas células y la expansión del tumor a otras partes del cuerpo (metástasis), procesos que inducen una mayor malignidad tumoral.
Así pues, el objetivo de este proyecto es reducir la producción de estas señales derivadas de la fermentación de la glucosa en la célula para frenar el crecimiento tumoral. Para esto se usará un compuesto que se sabe que permite interceder en este proceso. Sin embargo, este es tóxico para el páncreas, de modo que no se puede utilizar directamente como fármaco. Para poder usar dicho compuesto como medicamento fabricaremos una versión modificada, de forma que el compuesto esté bloqueado hasta que se encuentre cerca del tumor. Para este fin aprovecharemos que el ambiente de los tumores sólidos contiene baja disponibilidad de oxígeno.
Así pues, queremos fabricar un "pro-medicamento" que estará inactivo (inocuo) hasta que se encuentre con la situación de baja disponibilidad de oxígeno, en las proximidades del tumor. De este modo, se actuará sobre el metabolismo de las células tumorales, y por tanto se frenarán los efectos que favorecen la progresión tumoral, a la vez evitando los efectos secundarios en el páncreas.
Teniendo en cuenta que el cáncer causa una gran cantidad de muertes todavía hoy en día y más viendo que hay algunos tumores específicos como por ejemplo el cáncer de pulmón, en los cuales la esperanza de vida de los pacientes es todavía muy baja, de tener éxito con esta aproximación de tratamiento tal vez se podría prolongar dicha esperanza de vida o mejorar el pronóstico de estos pacientes, probablemente en combinación con otras terapias.
Identificación de nuevos puntos débiles para superar la resistencia en cáncer de mama metastásico
El cáncer de mama afecta aproximadamente 2.1 millones de personas cada año a nivel mundial, siendo el cáncer más frecuente en mujeres. El cáncer de mama positivo para receptores hormonales (RH+) representa el 75% de todos los cánceres de mama y es una de las principales causas de muerte por cáncer. Estos tumores se caracterizan por tener moléculas a las que se pueden unir hormonas femeninas (estrógenos y progesterona) favoreciendo el crecimiento de sus células.
Actualmente, la mayoría de tratamientos sistémicos para este grupo de pacientes son la terapia anti-hormonal, la quimioterapia y los inhibidores de CDK4/6, unos fármacos aprobados recientemente que evitan la multiplicación de las células del tumor.
Aun así, el cáncer de mama RH+ es muy heterogéneo a nivel clínico y a nivel biológico, y se puede clasificar en 4 subgrupos moleculares llamados Luminal A, Luminal B, HER2-enriched (HER2-E) y Basal-like. Los grupos Luminal A y Luminal B representan la mayoría de los casos RH + y la supervivencia de las pacientes con este tipo de tumores ha mejorado mucho desde la introducción de los fármacos inhibidores de CDK4 / 6.
En cambio, el grupo HER2-E, que afecta aproximadamente a 1 de cada 5 mujeres con cáncer de mama RH +, presenta resistencia a los inhibidores de CDK4/6 y tiene mal pronóstico.
En este estudio, el grupo de investigación se plantea dirigir dos cuestiones clínicamente relevantes:
1) Identificar mecanismos moleculares clave en la forma de responder de los tumores a los inhibidores de CDK4/6.
2) Diseñar nuevas estrategias para superar la resistencia a los inhibidores de CDK4/6. Para alcanzar estos objetivos, se proponen estudiar la biología de aproximadamente 200 tumores de cáncer de mama RH+.
Además, se utilizarán modelos de cáncer de mama en cultivos celulares y de ratón, así como metodologías innovadoras para aclarar los mecanismos moleculares de respuesta y resistencia a los inhibidores de CDK4/6 e identificar y validar nuevos tratamientos dirigidos.
En conjunto, los resultados preclínicos de este estudio llevarán al diseño de nuevos ensayos clínicos que finalmente contribuirán a mejorar el tratamiento y supervivencia de las pacientes con cáncer de mama hormonal.
Identificación de biomarcadores en sangre de pacientes con cáncer de mama luminal metastásico
Aproximadamente el 70% de los cánceres de mama diagnosticados tienen receptores hormonales. Estos tumores se caracterizan por tener moléculas a las que se pueden unir hormonas femeninas (estrógenos y progesterona) favoreciendo el crecimiento de sus células. Estos tumores se tratan con una terapia muy eficaz, la terapia anti-hormonal y, por tanto, tienen el mejor pronóstico. Sin embargo, algunas pacientes tienen tumores resistentes que se vuelven metastásicos, lo que significa que la enfermedad progresa. Recientemente, se ha incorporado a la clínica un nuevo tratamiento denominado "inhibidores de ciclina", que retrasa el inicio de esta progresión.
Sin embargo, esta terapia no funciona en algunas pacientes. Además, en aquellos casos que inicialmente el tratamiento funciona, con el tiempo deja de ser efectivo. El objetivo de este proyecto es conocer las causas por las que la terapia deja de funcionar en estas pacientes mediante el análisis de material tumoral en sangre, técnica que se conoce como biopsia líquida. Esta técnica no es invasiva para las pacientes (a diferencia de la biopsia de tejido) y permite conocer los cambios que se producen en el tumor como resultado del tratamiento. Para este estudio, se tomarán muestras de sangre de pacientes con cáncer de mama metastásico antes y después de la terapia para realizar un análisis del material tumoral.
Los investigadores cuidarán especialmente a las pacientes voluntarias, considerando que son una población sensible. Con este proyecto, se pretende mejorar la esperanza y la calidad de vida de las pacientes, al saber de antemano si el tratamiento funcionará e incluso identificando nuevas terapias potenciales.
Resultados destacados:
Mejorando los tratamientos basados en inhibidores de CDK4/6 en cánceres de mama avanzados
El cáncer de mama es el más frecuentemente diagnosticado en mujeres, y el segundo en mortalidad después del cáncer de pulmón. En 2020 el cáncer de mama constituyó el 12% de los tumores detectados en España. Existen diferentes rutas y mecanismos que influyen en el ciclo de vida de las células, su crecimiento y su proliferación. Dos moléculas críticas en estos procesos son las conocidas como CDK4 y CDK6.
Cuando las vías en las que influyen CDK4 y CDK6 se ven alteradas, puede tener lugar el desarrollo de un tumor. Existen fármacos capaces de bloquear la actividad de las moléculas CDK4 y CDK6 que han sido aprobados recientemente para el tratamiento de cáncer de mama avanzado. Y su eficacia en otros tipos de tumores está siendo activamente investigada. Estos inhibidores presentan ciertas limitaciones cuando son utilizados como tratamiento único, principalmente debido al desarrollo de mecanismos de resistencia de los tumores meses después de concluir el tratamiento.
Por ello, es fundamental profundizar en la investigación de nuevas estrategias que combinen el uso de estos inhibidores con otros fármacos que aumenten la eficacia y disminuyan el riesgo de recaída. En la actualidad, las terapias basadas en agentes que dañan el ADN y atacan a las células con mayor capacidad proliferativa, como las células tumorales, son la opción más utilizada en el tratamiento de cánceres de mama avanzados que no responden a terapias hormonales.
Puesto que los fármacos inhibidores de CDK4/6 paralizan la proliferación celular, no se esperaba que pudiesen combinarse con estos agentes quimioterapéuticos dirigidos a células proliferativas. Sin embargo, resultados recientes en el laboratorio donde se desarrolla este proyecto muestran un alto potencial cuando, en lugar de administrarse al mismo tiempo, se utilizan de forma intercalada, tanto en células de cáncer de páncreas como en muestras derivadas de pacientes inyectadas en modelos animales de ratón.
El objetivo de este proyecto es validar esta hipótesis utilizando diversas plataformas de investigación en cáncer de mama. Para ello se utilizarán cultivos celulares, organoides derivados de pacientes y ratones modificados genéticamente para tratar de replicar al máximo los diversos escenarios genéticos comunes en esta enfermedad. Estudiaremos la importancia de las moléculas CDK4/6 en tumores, así como la eficacia de su inhibición en combinación con otros tratamientos, haciendo hincapié en fármacos utilizados actualmente en la clínica. Esperamos que los resultados de este estudio arrojen luz sobre cómo podemos afrontar con mayor eficacia y rapidez el tratamiento del cáncer de mama.
Una nueva estrategia terapéutica para el tratamiento del cáncer basada en inmunoterapia
El sistema inmunitario puede reconocer los tumores como elementos extraños que deben ser eliminados. Una de las estrategias más prometedoras para potenciar la respuesta inmunitaria anti-tumoral (inmunoterapia), es la creación de contactos físicos entre el sistema inmunitario y las células del tumor que faciliten que las primeras maten a las segundas. Para poder generar estos contactos es necesario un factor de anclaje en la célula tumoral. Desafortunadamente, a pesar de los éxitos de estos tratamientos de inmunoterapia, las resistencias que desarrollan los tumores continúan siendo un obstáculo insuperable.
Recientemente este grupo de investigación ha establecido modelos de resistencia a terapias basadas en linfocitos T (células inmunitarias encargadas de defender al organismo y destruir tumores) e identificado un nuevo mecanismo de resistencia que tienen los tumores frente al ataque de estas células inmunitarias. De este modo, han demostrado que la deficiencia en un mecanismo llamado ruta de interferón-gamma, en las células tumorales, induce una resistencia intrínseca a la muerte producida por linfocitos T activos. Dados estos resultados, en este proyecto se quiere profundizar en el estudio de esta estrategia de resistencia de los tumores para encontrar nuevas alternativas de tratamiento que puedan ser rápidamente aplicadas en la práctica clínica.
Además, explorarán el mecanismo biológico de las células resistentes frente a las inmunoterapias en relación a la ruta del interferón-gamma. En resumen, este proyecto permitirá el desarrollo de una nueva y más eficaz estrategia terapéutica basada en inmunoterapia para el tratamiento del cáncer.
Programa para la prevención de complicaciones cardiovasculares en mujeres que reciben quimioterapia
Los avances en el tratamiento farmacológico de los pacientes con cáncer han tenido un impacto pronóstico positivo en su supervivencia. Sin embargo, varios tratamientos quimioterápicos se asocian a la posibilidad de desarrollar complicaciones cardiovasculares, junto a otros efectos secundarios, tales como la fatiga, pérdida de masa muscular, insomnio y alteraciones cognitivas, empeorando considerablemente la calidad de vida de estos pacientes. El correcto tratamiento del paciente oncológico no debe limitarse a las intervenciones curativas, cirugía, radioterapia o quimioterapia. Debe incluir otros aspectos como el soporte psicológico, el soporte social y los programas de ejercicio físico.
Los programas multidisciplinares de Rehabilitación Cardíaca son modelos que buscan mejorar los síntomas, la calidad de vida y el pronóstico de los pacientes con cardiopatía, por lo que podría ser un recurso extensible a otras patologías, tales como el cáncer, dando lugar a un programa de Rehabilitación Cardio-Oncológica.
Estrategias no farmacológicas complementarias al tratamiento convencional (principalmente farmacológico) como los programas de Rehabilitación Cardio-Oncológica favorecen una actitud proactiva del paciente en su proceso terapéutico, otorgándole parte de responsabilidad, empoderamiento y compromiso terapéutico. El ejercicio terapéutico, como componente central de estos programas, se reconoce cada vez más como una polipíldora sin efectos secundarios, con una implementación a bajo coste.
Se pretende difundir un modelo reproducible y exportable que permita su implementación en centros que dispongan de programas activos de Rehabilitación Cardíaca, estableciendo una nueva indicación de tratamiento en el paciente oncológico y favoreciendo la transferencia de los conocimientos científicos a la práctica clínica. Muchos de estos programas cuentan con instalaciones y gimnasios equipados que no son utilizados durante la jornada completa. Estas infraestructuras y el desarrollo de espacios compartidos de trabajo entre Oncología, Cardiología y Rehabilitación, abren la oportunidad a que el paciente oncológico se beneficie también de estos programas.
La coordinación de estas unidades asistenciales permite que los pacientes se sientan acompañados y supervisados por un equipo interdisciplinar que trata de abordar de forma integral sus necesidades.
Los proyectos de investigación como el propuesto para esta Tesis Doctoral, frecuentemente son precursores de la implementación de nuevos servicios asistenciales, estructurados y controlados, que aseguran una mayor calidad, seguridad y eficiencia de la atención sanitaria, frente a los modelos convencionales.
El objetivo de este proyecto de Tesis Doctoral pretende:
1. Analizar la eficacia de un programa multidisciplinar de rehabilitación cardíaca basado en ejercicio en la prevención de cardiotoxicidad (estudio ONCORE) y de otras complicaciones funcionales en mujeres con cáncer de mama que reciben quimioterapia cardiotóxica.
2. Promover estrategias complementarias basadas en el ejercicio terapéutico entre pacientes, profesionales e instituciones para mitigar los efectos indeseables de la quimioterapia.
Estudio de la heterogeneidad tumoral para mejorar el diagnóstico del cáncer de mama y su tratamiento de elección
El tratamiento que reciben las pacientes con cáncer de mama depende del subtipo de tumor diagnosticado. El más frecuente es el Luminal, mientras que el más agresivo y con peor pronóstico es el conocido como Tripe Negativo. Las pacientes con cáncer de mama Triple Negativo son tratadas con quimioterapia, dirigida a eliminar células en división, pero sin ninguna especificidad. El éxito del tratamiento depende de cada caso y es frecuente que el tumor reaparezca a los 2 – 3 años.
Los tumores de mama son heterogéneos, es decir están formados por diferentes tipos de células que pueden responder de distinta manera a un tratamiento específico. Para llevar a cabo este proyecto utilizaremos tumores de pacientes con cáncer de mama para validar nuevos biomarcadores, buscaremos nuevos compuestos que eliminen específicamente algunas células tumorales e identificaremos nuevos factores claves implicados en la conversión celular con el fin de sensibilizar poblaciones de células que eran inicialmente resistentes, permitiendo que, terapias que actualmente no afectan a estas células, ahora sí lo hagan.
Esta propuesta sugiere que una terapia basada en la combinación de varios medicamentos, dirigida a diferentes poblaciones celulares al mismo tiempo, podría erradicar el tumor mejorando la calidad de vida de muchas pacientes con cáncer de mama luminal resistentes a terapias hormonales o triple negativas.
Nuestro proyecto tiene dos objetivos: 1) refinar el diagnóstico del cáncer de mama usando nuevos marcadores que puedan ayudarnos a subclasificarlos mejor, y 2) encontrar alternativas terapéuticas a las actuales, que aumenten el éxito del tratamiento reduciendo el porcentaje de recaídas y evitando o ralentizando la aparición de metástasis.
Entender el proceso de la resistencia a la quimioterapia para mejorar su eficacia en pacientes con cáncer de mama triple negativo
El cáncer de mama es el más diagnosticado, con más de 33.000 nuevos casos en España en 2019, y el segundo con mayor mortalidad entre mujeres. A pesar de que las tasas de supervivencia han aumentado a lo largo de los años, hay un tipo de cáncer de mama conocido como triple negativo que supone un 10-20% de todos los casos, que es particularmente agresivo y tiende a tener peor prognosis y mayor probabilidad de recaída. A diferencia de otros tumores de mama, los triple negativos no tienen ninguna característica que pueda ser atacada con terapias dirigidas, por lo que se tratan con quimioterapia general. Una de las opciones preferentes para el tratamiento de estas pacientes es la combinación de dos drogas llamadas taxanos y antraciclinas.
Aunque este tratamiento disminuye la progresión tumoral y, en general, aumenta la supervivencia, algunas pacientes apenas responden y acaban desarrollando resistencia y metástasis, que es la principal causa de muerte. Dado que estas dos drogas constituyen la primera línea de tratamiento en cáncer de mama triple negativo y que no existe ninguna alternativa actual, es fundamental entender los mecanismos que permiten a los tumores desarrollar resistencia a los quimioterapéuticos. Esto permitiría aumentar la eficacia del tratamiento y por tanto disminuir en lo posible la recurrencia y las metástasis, mientras que también ayudaría a predecir la respuesta a la quimioterapia y a diseñar terapias más personalizados, todo lo cual supondría una mayor supervivencia de estas pacientes.
Este proyecto propone investigar cómo los tumores triple negativos son capaces de sobrevivir a los tratamientos anti-tumorales. Utilizaremos una tecnología que permite analizar los diferentes tipos de células presentes en el tumor y cómo cambian estas poblaciones en respuesta a la quimioterapia. Además, usaremos técnicas de cribado genético para identificar factores que faciliten la resistencia de las células tumorales a las drogas. Combinando ambas estrategias esperamos encontrar características que predigan la respuesta de las pacientes a la quimioterapia, así como identificar posibles dianas cuya intervención potencie el efecto de los quimioterapéuticos, lo cual podría ayudar a diseñar nuevos tratamientos más efectivos.
Atacando a los “jugadores” no tumorales del microambiente tumoral para mejorar la eficacia de las terapias actuales y prevenir la metástasis
Aunque los tumores localizados tienen bastantes probabilidades de ser tratados con éxito mediante cirugía y/o radioterapia, son los tumores metastásicos, es decir, los que se han expandido a varias partes del cuerpo, los responsables de la gran mayoría de muertes por cáncer, ya que la medicina aún no es capaz de ofrecer soluciones eficaces para muchos de ellos.
Durante el proceso de malignización, los tumores adquieren la capacidad de promover la formación de nuevos vasos sanguíneos (angiogénesis) y linfáticos (linfangiogénesis) que las células cancerosas utilizan para migrar, colonizar ganglios linfáticos regionales y finalmente invadir otros tejidos, lo que lleva a un peor pronóstico.
El proyecto dirigido por la Dra. Melissa García Caballero, del Departamento de Biología Molecular y Bioquímica de la Universidad de Málaga e IBIMA, tiene como objetivo principal estudiar la reprogramación de las células endoteliales (células que revisten los vasos sanguíneos) presentes en el microambiente tumoral, es decir las células que rodean el tumor.
Se utilizará una amplia batería experimental con aproximaciones moleculares, cultivos celulares y modelos tumorales animales, que permitirá la identificación de nuevas dianas terapéuticas (puntos débiles del tumor) y el desarrollo de fármacos más eficaces para inhibir la formación de estos vasos.
Este proyecto abordará desde la investigación básica a la investigación traslacional, con el fin último de contribuir al descubrimiento de estrategias más prometedoras y de amplia aplicación en pacientes oncológicos con tendencia a desarrollar metástasis.
Desarrollo de tecnologías de secuenciación directa de ARN para la rápida detección y monitorización de cáncer
El diagnóstico temprano de cáncer está altamente correlacionado con una buena prognosis y mayores tasas de supervivencia de cáncer. Para aumentar la proporción de pacientes de cáncer que son diagnosticados en estadios tempranos de la enfermedad, es necesario utilizar herramientas que permitan la detección y monitorización de cáncer en biopsias líquidas.
En este sentido, el descubrimiento de ARNs pequeños (moléculas reguladoras de la actividad de los genes) pero estables en el plasma sanguíneo ha generado mucho interés en desarrollar métodos para poder cuantificarlos, ya que estos ARNs están típicamente alterados en pacientes con cáncer.
Por desgracia, todavía no tenemos un método simple, económico y de alta precisión que permita cuantificar estas moléculas en muestras biológicas.
En este proyecto, propongo establecer una nueva tecnología de secuenciación, la tecnología de nanoporos, para cuantificar las abundancias de ARNs pequeños en muestras biológicas, y usar inteligencia artificial para predecir si la muestra es “normal”, “cancerosa” o “metastásica”. Utilizando esta metodología, queremos determinar la malignidad de una muestra en menos de 3 horas, y por un coste no superior a 50 euros por muestra.
Dieta, actividad física y composición corporal en el pronóstico del cáncer de mama
Algunos elementos de la dieta, la falta de actividad física y el exceso de grasa corporal (obesidad) aumentan el riesgo de padecer cáncer de mama. Sin embargo, no está claro qué papel tienen estos factores en la progresión de la enfermedad en mujeres a las que ya se les ha diagnosticado el tumor (pronóstico), debido, al menos en parte, a la falta de estudios adecuados, ya estos son caros y requieren mucho tiempo. El grupo liderado por el Dr. Agudo dispone de los datos recogidos en dos estudios con las características indicadas para este propósito. En este proyecto realizarán un análisis exhaustivo de los datos con el objetivo de aclarar el papel de la dieta, la actividad física y la composición corporal en el pronóstico del cáncer de mama.
En primer lugar, utilizarán los datos del proyecto EPIC, un estudio que se ha desarrollado en nueve países europeos, que actualmente incluye más de 13.000 mujeres que han sido diagnosticadas de cáncer de mama. En todas ellas se recogió, de forma muy detallada, información sobre su dieta habitual, la actividad física y medidas corporales (peso, talla). Con estos datos evaluaremos si las mujeres diagnosticadas de cáncer de mama con obesidad, físicamente inactivas o con dietas no saludables tienen peor supervivencia que las que tenían un peso normal, físicamente activas o con dietas más saludables.
Por otro lado, el ensayo clínico PREDICOP incluye 620 mujeres diagnosticadas de cáncer de mama. Una vez finalizado el tratamiento, aproximadamente la mitad de estas mujeres siguieron un programa específico de dieta y ejercicio físico durante un año, mientras que la otra mitad (el grupo control) siguió las recomendaciones habituales establecidas en su hospital. A todas ellas, además de sus hábitos alimentarios, se les recogió información sobre su actividad física, medidas de composición corporal, y calidad de vida. En este proyecto se evaluará si las mujeres que siguieron el programa, al cabo de un año, han mejorado su alimentación y su nivel de actividad física, si han controlado su peso y, sobre todo, si ha mejorado su calidad de vida.
CÉLULAS INMUNITARIAS MODIFICADAS CON RECEPTORES ARTIFICIALES CAR PARA EL TRATAMIENTO DEL CÁNCER
En los últimos años, la terapia con células CAR-T ha demostrado un enorme potencial para el tratamiento del cáncer. La terapia con células CAR-T es un tipo de inmunoterapia en la que las células inmunes se recolectan de la sangre de los pacientes y se modifican genéticamente para añadirles un receptor artificial (llamado CAR) en su superficie, una molécula que funciona como un ''buscador'' que ayuda a las células inmunes (linfocitos T) a encontrar mejor a los tumores para destruirlos. Estas células genéticamente modificadas se infunden nuevamente al paciente para que reconozcan el cáncer como extraño y lo eliminen. La terapia con células CAR-T ha tenido un éxito clínico sin precedentes en pacientes con cánceres de la sangre, hecho que ha permitido su aprobación y entrada en el mercado. Sin embargo, las células CAR-T no han demostrado eficacia para el tratamiento de tumores sólidos, como los tumores de mama, pulmón o pancreáticos. Esto se debe a que los tumores sólidos utilizan múltiples mecanismos para escapar del sistema inmunitario. En este proyecto, utilizaremos la ingeniería genética para modificar aún más las células CAR-T para que superen los obstáculos que encuentran en los tumores sólidos. Modificaremos las células CAR-T para aumentar su llegada y supervivencia en el tumor y para que liberen drogas citotóxicas que las ayuden a eliminar el tumor. El objetivo final de este proyecto es obtener una terapia CAR-T mejorada para el tratamiento de tumores sólidos.
ESTRATEGIA DE NUTRICIÓN PERSONALIZADA PARA SUPERVIVIENTES DE CÁNCER DE MAMA SEGÚN SUS CARACTERÍSTICAS METABÓLICAS
El objetivo de este proyecto es desarrollar una estrategia de nutrición personalizada para supervivientes de cáncer de mama para evitar posibles complicaciones de salud, o incluso recurrencia de cáncer. Esta estrategia personalizada, que está basada en sus características metabólicas individuales, proporcionará una guía de las recomendaciones dietéticas óptimas para obtener un perfil nutricional saludable.
Utilizaremos las últimas herramientas biotecnológicas para obtener información sobre el estado nutricional de cada paciente (niveles de omega 3, vitaminas, minerales…).
También analizaremos genes específicos relacionados con el metabolismo de diferentes nutrientes para evaluar la respuesta de cada participante respecto a determinadas recomendaciones nutricionales. De esta forma, se proporcionarán pautas dietéticas personalizadas a cada participante en un ensayo clínico de un año de duración. Para evaluar el éxito del programa nutricional se compararán los parámetros metabólicos al inicio y al final de estudio y además se relacionarán con otros aspectos como su peso corporal, niveles de colesterol, glucosa, toxicidad asociada a tratamientos anteriores, salud digestiva (mediante el estudio composición de su microbiota intestinal o bacterias que viven en nuestro sistema digestivo) y su calidad de vida. Como resultado, esperamos diseñar un programa de nutrición personalizada, con potencial de transferencia al mercado y que sea económicamente accesible para las pacientes.
LA RIGIDEZ TUMORAL COMO POSIBLE DIANA EN LA INMUNOTERAPIA DEL CÁNCER
La inmunoterapia (la estimulación y utilización de la propia respuesta inmune del paciente frente al cáncer) es una estrategia antitumoral relativamente reciente, prometedora frente a diferentes tipos de cáncer. Un ejemplo prominente es el bloqueo de una señal utilizada por muchos tumores para ´adormecer´ a células inmunes y evadir su ataque, una molécula llamada PD-L1. Sin embargo, existe variabilidad significativa entre individuos, y hay ciertos tipos de tumores en los que esta terapia no resulta efectiva. Una característica común en tumores en los que no funcionan bien las inmunoterapias es que su estroma (el tejido asociado al tumor que da sustento y nutre a las células tumorales) es abundante y rico en material fibroso y duro, con una vascularización pobre y alterada. De este modo, funciona como un escudo que protege al tumor. El cáncer de mama triple negativo (TNBC), la forma de mayor mortalidad y con menores opciones terapéuticas, es un claro ejemplo de este escenario. Esto dificulta físicamente la entrada en el tumor de células inmunes, y constituye un ambiente propicio para el escape de las células tumorales y desarrollo de metástasis. Por ello, entender cómo se determina la arquitectura del estroma en el tumor, y su influencia en mecanismos importantes para la eficacia de distintas terapias, es una cuestión prioritaria.
Nuestro proyecto pretende comprender cómo una molécula clave en la comunicación entre células tumorales y el estroma, llamada Caveolina-1, contribuye a través de dos mecanismos a la respuesta inmune frente al tumor: 1) Mediante el control de la composición, vascularización y propiedades físicas del estroma del tumor, que afecta a su vez a la accesibilidad y actividad de células inmunes. 2) Mediante la modulación de la exposición, a través de un nuevo mecanismo de secreción (exosomas), del punto de control inmunitario PD-1/PD-L1, uno de los elementos claves de la respuesta a inmunoterapia. Nuestros estudios, de interés no sólo para el cáncer de mama triple negativo sino para la biología de otros tipos tumorales, tienen un doble valor potencial: la evaluación de nuevos indicadores que ayuden a predecir la respuesta de un tumor a la inmunoterapia, y la identificación de nuevos puntos débiles de estos tumores a los que atacar para optimizar dicha respuesta.
Resultados destacados:
ESTUDIO DE ALTA RESOLUCIÓN DE LAS DESIGUALDADES SOCIALES EN CÁNCER EN ESPAÑA
La magnitud del cáncer está aumentando a nivel mundial debido fundamentalmente al envejecimiento de la población. Para hacer frente a esta “epidemia de cáncer”, es esencial profundizar en el estudio de las diferencias geográficas y socioeconómicas en la incidencia del cáncer, la mortalidad y la supervivencia de los pacientes con cáncer.
Estudios de otros países han demostrado que las personas que viven en áreas geográficas socioeconómicamente desfavorecidas tienen más probabilidad de desarrollar o morir de cáncer. Sin embargo, en España las desigualdades sociales en cáncer no están bien documentadas. En este proyecto vamos a estudiar las desigualdades geográficas y socioeconómicas en los resultados del cáncer (en términos de incidencia, mortalidad y supervivencia de los pacientes) mediante un nuevo Índice desarrollado por la Sociedad Española de Epidemiología. En concreto, vamos a caracterizar el coste humano y económico que suponen estas desigualdades en nuestro país utilizando métodos epidemiológicos y estadísticos de vanguardia. Para ello, vamos a utilizar datos de 8 registros de cáncer de población adscritos a la Red Española de Registros de Cáncer (REDECAN) sobre los tres cánceres más frecuentes en nuestro país (pulmón, mama y colorectal) y dos cánceres menos frecuentes (melanoma cutáneo y linfoma no-Hodgkin). Un análisis profundo de las desigualdades sociales y sus posibles causas es valioso porque las desigualdades pueden eliminarse mediante el control de factores de riesgo, mejoras en la atención sanitaria u otras intervenciones. Por lo tanto, esperamos que los resultados de este proyecto vayan a tener implicaciones, tanto para las políticas sociales, como para la organización y la prestación de servicios de atención sanitaria en pacientes con cáncer en España.
Estratificación de los pacientes para la medicina oncológica de precisión
Hay tumores que aparecen porque las células son incapaces de reparar su material genético adecuadamente, un problema que aparece por mutaciones en algunos genes encargados de esta función. Un ejemplo de estos, son los genes llamados BRCA.
Los tumores que tienen los genes BRCA alterados responden muy bien a ciertas quimioterapias y a una nueva terapia dirigida llamada inhibidores de PARP (PARPi). Esta nueva terapia se basa en bloquear a la molécula PARP, que permite a los tumores reparar los daños en el material genético producidos por la quimioterapia haciendo que resistan. Al inhibir este reparador, el tumor puede morir.
Sin embargo, no todos los pacientes responden bien a este tratamiento. Por ello es necesario encontrar herramientas que permitan clasificar mejor a los pacientes para preveer cuales se van a beneficiar y cuáles no. Nuestro laboratorio ha desarrollado un nuevo test basado en la visualización de los niveles de una molécula de reparación del ADN llamada RAD51 que permite establecer si las células tumorales tienen defectos en la reparación del ADN, más allá de las mutaciones en los genes BRCA. Además, estos defectos pueden afectar el microambiente tumoral (el entorno que rodea al tumor).
Este proyecto tiene como objetivo establecer los valores predictivos y pronósticos del test de RAD51 en cuatro tipos principales de cáncer (mama, ovario, próstata y endometrio). Nuestro propósito es estratificar mejor a los pacientes para el tratamiento contra el cáncer y proponer combinaciones de medicamentos más efectivas para reducir las recaídas y mejorar su supervivencia de los pacientes.
LA LECHE MATERNA COMO BIOPSIA LÍQUIDA PARA LA DETECCIÓN PRECOZ Y NO INVASIVA DEL CÁNCER DE MAMA ASOCIADO AL EMBARAZO
La leche materna se origina en el tejido lobulillar, que está distribuido por toda la glándula mamaria y que durante la lactancia se transporta a través de los conductos mamarios.
Es muy probable qué si existe un tumor en la mama, parte del ADN tumoral circule a través de este líquido, conociéndose como ADN tumoral circulante (ctDNA), y el cual podemos detectar en la leche materna. En estudios preliminares, pudimos aislar ctDNA en la leche materna de 6 pacientes de cáncer de mama asociado al embarazo, incluso en pacientes en estadio temprano. Observamos que las mutaciones del tumor también estaban presentes en el ctDNA aislado de la leche materna. Además, en 5 pacientes, se analizaron muestras de sangre y de leche recogidas a la vez, y solamente en una de ellas se detectó ctDNA en ambas muestras. Era una paciente portadora de un gran tumor del tipo T3N3.
Nuestra hipótesis es que la detección de ctDNA en leche materna puede utilizarse como nuevo biomarcador no invasivo para el diagnóstico precoz del cáncer de mama asociado al embarazo. Los objetivos del estudio son:
1. Cuantificar el ctDNA y la fracción alélica mutante (MAF) en leche materna.
2. Medir la sensibilidad, especificidad y precisión de la detección de ctDNA en la leche materna y la sangre mediante diferentes técnicas para diagnosticar el cáncer de mama asociado al embarazo.
Para ello, realizaremos un estudio de casos y controles que incluye pacientes con cáncer de mama asociado al embarazo (casos) y pacientes embarazadas con mayor riesgo que la población general de desarrollar cáncer de mama: mujeres de 40 años o más, portadoras de mutaciones de genes con mayor riesgo de cáncer de mama o antecedentes de cáncer de mama (controles).
Para detectar el ctDNA se combinarán técnicas de secuenciación de última generación y paneles de genes específicos para el cáncer de mama. Las mutaciones detectadas en la leche materna se compararán con muestras de sangre y tumor de las mismas pacientes.
NUEVOS MARCADORES DE INMUNOTERAPIA EN CÁNCER DE MAMA TRIPLE NEGATIVO AVANZADO O METASTÁSICO
El cáncer de mama triple negativo representa el 10-15% de todos los tumores de mama. Es el más agresivo y su tratamiento resulta complicado. Las células del cáncer triple negativo de seno presentan muchísima heterogeneidad, es decir, que sus las distintas células del tumor son muy variables entre ellas, lo que dificulta el tratamiento de la enfermedad. Estos tumores no presentan puntos débiles a los que atacar, como pueden tener otros tipos de cáncer, por lo que no hay tratamientos específicos para tratarlos y las opciones son limitadas. Y aunque, el cáncer de seno triple negativo tiende a responder bien a la quimioterapia inicial, suele desarrollar más resistencia y provocar más recaídas que otros tumores.
La inmunoterapia está demostrando tener un un efecto positivo contra estos tumores. Nuevos datos revelan su beneficio sobre la supervivencia y la posibilidad de identificar a aquellas pacientes que mejor van a responder a este tratamiento.
La inmunoterapia, también denominada terapia biológica, es un tipo de tratamiento para el cáncer que estimula las defensas naturales del cuerpo para atacar al cáncer. Utiliza moléculas producidas por el cuerpo o fabricadas en un laboratorio para mejorar o restaurar la función del sistema inmunitario.
Cuando el sistema inmunitario del cuerpo detecta algo nocivo, produce anticuerpos. Por lo tanto, una de las funciones normales del sistema de defensa del cuerpo es detectar y destruir las células anormales e impedir o frenar el crecimiento de muchos cánceres. Por ejemplo, las células inmunitarias se encuentran algunas veces en los tumores o alrededor de ellos. Estas células son llamadas linfocitos infiltrantes de tumores o TIL, y son un indicio de que nuestro sistema inmunitario está reaccionando al tumor. Las personas cuyos tumores tienen elevado TIL con frecuencia les va mejor este tipo de tratamiento que aquellos pacientes cuyos tumores no los tienen.
Aun cuando el sistema inmunitario puede combatir o retardar el crecimiento del cáncer, las células cancerosas tienen muchas maneras de eludir su destrucción por el sistema inmunitario de diferentes formas. Por lo tanto, la inmunoterapia ayuda al sistema inmunitario a actuar mejor contra el cáncer. Se utilizan varios tipos de inmunoterapia para tratar el cáncer.
En nuestro proyecto nos focalizamos en un tipo de inmunoterapia basada en inhibir puntos de control inmunitarios. Unas moléculas que tienen el papel de evitar que el sistema inmunitario sea agresivo y ataque a las células sanas del cuerpo. Funcionan como unos frenos en la superficie de las células inmunitarias que, cuando se pulsan, la célula sana impide que la célula inmunitaria la ataque.
Sin embargo, los tumores pueden utilizar esta estrategia a su favor para que el sistema inmunitario no le ataque, y los medicamentos llamados inhibidores de punto de control inmunitario actúan bloqueando este mecanismo que ‘’apaga a las células inmunitarias’’ Estas vías se conocen como puntos de control inmunitarios, entre los que se encuentra una molécula llamada PD-L1.
En este escenario, el cáncer de mama triple negativo tiene niveles muy altos pudiéndose bloquear con fármacos específicos. Así, la inmunoterapia está demostrando tener un papel muy positivo en el manejo de este tipo de cáncer de mama. No obstante, hay algunas mujeres que no responden bien a la inmunoterapia, entre las que se encuentran pacientes con cáncer avanzado que se ha diseminado al hígado, al pulmón o al hueso. Por lo tanto, nuestro objetivo principal es identificar un indicador, un marcador que nos permita asegurar qué pacientes responderán bien al tratamiento.
En concreto, estudiaremos una familia de moléculas llamadas Notch, que cumplen un rol importante en el crecimiento, migración, invasión y metástasis de las células del cáncer de mama, y su activación anormal se asocia con un mal pronóstico, resistencia a los tratamientos y recaída, en particular en el cáncer de mama triple negativo. Para comprobar si sus niveles permiten identificar a los pacientes con este tipo de cáncer en estado avanzado que puedan beneficiarse de estas costosas terapias usando métodos no invasivos.
EL PAPEL DE LAS INTERACCIONES ENTRE MOLÉCULAS MEDIADORAS DE LA MUERTE CELULAR Y SU USO COMO DIANA TERAPÉUTICA
El campo de la investigación en oncología requiere de un constante avance para hacer frente a todos los retos que nos presentan la amplia diversidad de tumores. A pesar de que el cáncer es la segunda causa de muerte a nivel mundial y ha habido grandes avances en los últimos años, sigue existiendo la necesidad de identificar y evaluar nuevas dianas terapéuticas, nuevos elementos característicos de los tumores que puedan suponer un punto débil al que atacar. Las moléculas de la familia Bcl-2 participan directamente en la muerte celular. Los diferentes miembros de esta familia interactúan entre sí para decidir el destino de las células en su ciclo de vida. Poder inducir la muerte celular en tumores es un objetivo clave en el ámbito oncológico y su capacidad para evadirla un mecanismo generalizado en el desarrollo tumoral y en la aparición de resistencias a terapias actuales.
Ahora imaginemos que las moléculas Bcl-2 son como porteros que interaccionan entre sí abriendo o cerrando puertas. Dentro de toda la familia hay moléculas que favorecen la apertura de las puertas y otras que las mantienen cerradas. Cuando se abren las puertas se desencadena la muerte celular.
Se ha demostrado que el aumento de la concentración de alguna de estas ‘’moléculas portero’’ que mantienen las puertas cerradas son indicadores de un pronóstico grave y de una menor supervivencia en cáncer y por tanto un posible objetivo al que atacar. Tanto es así, que moléculas que actúan sobre dichos ‘’porteros’’ dan buenos resultados en el tratamiento de diferentes tipos de cáncer de mama, pulmón, melanoma o colorrectal.
Nuestro grupo de investigación estudia a nivel molecular cual es la función de una región de estas ‘’moléculas portero’’, llamada región transmembrana, y cómo influye en la apertura de puertas y en consecuencia, en la muerte celular.
Cuando las ‘’moléculas portero’’ interaccionan por esta región, las puertas no se abren y no se produce la muerte celular. El grupo ha identificado varias moléculas que se comportan como llaves provocando la apertura de las puertas y desencadenando así la muerte celular. El objetivo del proyecto es avanzar en la caracterización de estas ‘’moléculas llave’’ identificadas por el grupo, evaluando su actividad antitumoral en modelos animales de cáncer de mama y cultivos derivados de pacientes de cáncer de pulmón.
Para ello, primero evaluaremos la actividad quimioterápica de los 4 compuestos identificados como antitumorales. En este momento, se estudiará la efectividad de estos compuestos y su capacidad de desencadenar la muerte celular.
El segundo paso será testar la actividad de las moléculas descritas con otros fármacos antitumorales que ya se usan en clínica. Una vez tengamos las moléculas o las combinaciones de moléculas, si las hubiese, se evaluará su actividad en líneas celulares derivadas de pacientes de cáncer de pulmón y en un modelo de ratón de cáncer de mama.
Por último, también se pretende identificar las mutaciones en las moléculas de la familia Bcl-2 presentes en pacientes, y estudiar cómo afectan al desarrollo de tumores resistentes, para así poder adelantarnos a futuras resistencias.
Estrategia en terapias antitumorales avanzadas basada en un microARN
El cáncer es una enfermedad genética que ocurre cuando tienen lugar mutaciones que inducen el desarrollo de un tumor. No obstante, en el material genético también ocurren cambios que afectan al funcionamiento del material genético aunque no afectan directamente a la secuencia de ADN (alteraciones epigenéticas), los cuales están implicados también en el desarrollo de cáncer.
En los últimos años, numerosos estudios han confirmado que estos cambios epigenéticos son clave en un proceso llamado reprogramación celular que da lugar a las células denominadas células madre del cáncer, que son capaces de resistir a los tratamientos y promover la progresión tumoral.
En este proyecto planteamos la posibilidad de usar una molécula microscópica llamada microRNA que afecta a los ya mencionados cambios epigenéticos, para atacar directamente a la población de células madre en el tumor. Este proyecto puede aportar una nueva perspectiva a la terapia antitumoral basada en mermar la población de células “stem” en el tumor, no solo evitando el crecimiento tumoral sino también frenando la aparición de nuevos tumores derivados de metástasis.
Nuevas terapias para el cáncer de mama hormonal
El cáncer de mama es un problema sanitario de alta prevalencia (1 de cada 8-10 mujeres lo padecen y el 30% de las mismas morirán de esta enfermedad).
Hay tumores de mama cuyas células tienen en su superficie unas moléculas llamadas receptores de estrógenos, donde esta hormona se une y provoca el crecimiento y la propagación del tumor. La terapia para estos tumores se basa en bloquear estos receptores para que los estrógenos no puedan unirse y, de esta manera, impedir el crecimiento del tumor. Estos fármacos son la clave en el tratamiento de la mayoría de estos tumores, sin embargo, a pesar de su alta eficacia, los tumores a largo plazo son capaces de desarrollar resistencias y provocar recaídas.
Esto representa un problema con alto impacto terapéutico ya que la principal causa de muerte en las pacientes con cáncer de mama se debe a la presentación de recidivas o progresión de la enfermedad, que se puede dar en forma de crecimiento tumoral bajo tratamiento, bien sea desde el inicio o tras un tiempo de remisión.
Nuestro grupo de investigación en estudios previos han identificado ciertas moléculas que poseen un elemento en su estructura llamado Zinc Finger (ZnF), como posibles responsables de esta resistencia endocrina. Ante esto, hemos diseñado y sintetizado varios compuestos con potencial actividad antitumoral selectiva para tumores resistentes a tratamiento hormonal, que actúan sobre este elemento ZnF, objeto de patente, y que dotan al proyecto de una gran orientación traslacional (aplicable a los pacientes).
Así, el presente proyecto de investigación tiene como objetivo desarrollar formas de detectar clínicamente la resistencia a terapias anti-estrogénicas y estudiar la eficacia terapéutica de los primeros compuestos inhibidores de Zinc-fingers que puedan servir para sensibilizar a los tumores resistentes a tratamiento hormonal.
Software de inteligencia artificial para el diagnóstico de nódulos mamarios y tiroideos
La ecografía es una técnica de imagen cada vez más utilizada en medicina por ser barata, segura (no emite radiación), y por permitir la visualización de imágenes en tiempo real. No obstante, es una técnica poco reproducible lo que dificulta la comparación de imágenes obtenidas con distintos ecógrafos o tras modificar los ajustes de un mismo ecógrafo; e incluso de una misma lesión en el tiempo, aunque se utilicen el mismo ecógrafo y los mismos ajustes, ya que la exploración es también dependiente de quién opera la sonda ecográfica. Además la interpretación ecográfica es subjetiva y muy dependiente de la experiencia del intérprete; lo que lleva cada año a hacer miles de biopsias innecesarias.
El equipo del Dr. Valderrábano ha desarrollado una tecnología que resuelve estos problemas técnicos y hace que la imagen ecográfica sea reproducible y pueda ser analizada de una forma objetiva y eficiente facilitando enormemente el desarrollo de soluciones diagnósticas mediante inteligencia artificial. La ayuda AECC Innova, va a permitir el desarrollo de las primeras dos soluciones diagnósticas que utilicen esta tecnología: una para el cáncer de tiroides y otra para el cáncer de mama.
En ambos órganos, se realizan más de 250.000 biopsias anuales en España, más de la mitad de las cuales tienen resultados benignos. Nuestras soluciones diagnósticas evitarán en el futuro miles de biopsias innecesarias cada año, así como la ansiedad asociada a un posible diagnóstico de cáncer mientras se esperan sus resultados. Estas soluciones, además, contribuirán a un uso más eficiente de los recursos sanitarios, tanto económicos como humanos.
Desarrollo de nanodispositivos basados en nanopartículas mesoporosas de sílice dirigidas al microambiente tumoral para el tratamiento del cáncer de mama
El cáncer de mama es el más común en mujeres de todo el mundo. A pesar de los avances en el diagnóstico, cirugía y desarrollo de nuevos fármacos, numerosas pacientes siguen recayendo como consecuencia de la resistencia a los tratamientos actuales. Las terapias anticancerígenas han estado tradicionalmente dirigidas a las células tumorales. Sin embargo, el microambiente tumoral desempeña un papel fundamental en el mantenimiento del tumor y en el desarrollo de resistencias a los tratamientos.
Los fibroblastos asociados al tumor (CAFs) y los macrófagos asociados al tumor (TAMs) son las poblaciones mayoritarias en el estroma tumoral y responsables en gran medida de la progresión tumoral y de las características inmunosupresoras. Entre las nuevas aproximaciones terapéuticas en el tratamiento del cáncer cabe destacar el uso de nanopartículas, las cuales pueden liberar su contenido a un tipo celular específico, evitando sus efectos sobre tejidos sanos. Las nanopartículas mesoporosas de sílice (MSNs) son biocompatibles, poseen una gran área superficial, gran tamaño de poro, estabilidad química y térmica, y la posibilidad de regular la morfología y el tamaño de los poros, permitiendo además la adsorción o encapsulación de cantidades significativas de moléculas bioactivas. Una de sus mayores ventajas es que su superficie permite la funcionalización con moléculas que actúan como "puertas moleculares", permitiendo una liberación controlada de la especie almacenada. En este proyecto se propone el diseño de una nanopartícula MSN dirigida a la proteína activadora de fibroblastos (FAP), que se encuentra altamente expresada en CAFs y TAMs activados. La nanopartícula será cargada a su vez con el citotóxico doxorrubicina, que será liberado específicamente en estos tipos celulares. Una vez liberada en el microambiente tumoral, la doxorrubicina tiene la capacidad de atravesar las membranas celulares accediendo así a las células tumorales.
Nuestro objetivo es probar que esta novedosa estrategia terapéutica que combina el ataque farmacológico del microentorno tumoral y la célula cancerígena es más eficaz para tratar el cáncer de mama e impedir resistencias que los tratamientos convencionales.
Desarrollo de nuevos complejos metabólicos para terapia y fototerapia del cáncer
El cáncer, una de las principales causas de mortalidad en el mundo, está considerado como un problema de salud pública cuyo impacto económico y social es de gran importancia. A pesar de los avances en la quimioterapia contra el cáncer, muchos de los tratamientos presentan una alta toxicidad, además de la incidencia de la resistencia a la muerte celular en tumores, que cada vez es más prevalente. La finalidad de este proyecto es diseñar, caracterizar y evaluar la eficacia biológica de nuevos complejos metálicos para la terapia de cáncer en modelos celulares in vitro con el objetivo de elucidar los mecanismos de acción anticancerígena. Además, se pretende explorar el desarrollo de nuevos complejos para la terapia fotodinámica del cáncer, que consiste en la activación de los agentes anticancerígenos mediante luz visible en el interior celular.
Los resultados de este proyecto supondrán un avance en la comprensión de la biología del cáncer, facilitando la generación de un conocimiento más amplio en el ámbito de la química biológica y abriendo nuevas líneas de investigación en farmacología, oncología y biomedicina.
Inmuno-nanoterapia adoptiva para el tratamiento del cáncer de mama triple negativo en modelos in vitro derivados de pacientes
Para el cáncer de mama triple negativo (TNBC), con una elevada tasa de recaídas, metástasis y mortalidad, aún no existen terapias dirigidas aprobadas. Hemos demostrado que ATF4 es un biomarcador de agresividad y mal pronóstico en pacientes con TNBC, así como una atractiva diana terapéutica para reducir su progresión. En el presente proyecto proponemos testar terapias dirigidas frente a ATF4 en modelos de organoides derivados de pacientes con TNBC.
Con el fin de conseguir una administración más dirigida de las terapias a investigar, e incrementar la tasa de éxito futura en pacientes, proponemos aprovecharnos de la capacidad de evasión inmune (EI) de las células tumorales y de las limitaciones asociadas a la inmunoterapia a través de la implementación de una "nanoterapia adoptiva" mediante el uso de nano-ghosts (NGs). Para ello emplearemos células inmunes sanguíneas de pacientes con TNBC para crear NGs naturalmente recubiertos con las moléculas usadas por las células tumorales para la EI. De este modo, en su administración autóloga, se acumularan sobre las células tumorales y liberarán su carga terapéutica a modo de caballos de Troya. Con esta propuesta avanzaremos en la medicina personalizada en pacientes con TNBC y abriremos la puerta al uso de la nanoterapia adoptiva en pacientes con cáncer.
Investigando el papel del estroma en el microambiente tumoral
Los fibroblastos son unas células que forman parte del microambiente tumoral, el entorno que rodea al tumor, que favorecen la progresión, la migración a otras partes del organismo y la resistencia del tumor a los tratamientos formando un tejido fibroso (matriz extracelular) que envuelve al tumor.
El estudiar y atacar a estas células se plantea como una alternativa de tratamiento. Sin embargo, es necesario entender la naturaleza de estas células, cómo y por qué aparecen favoreciendo el desarrollo tumoral y su papel en la propia enfermedad, con el fin de poder ver cómo avanzar frente a este problema.
Este proyecto busca estudiar el papel de los fibroblastos en la aparición del tumor, los procesos que las regulan y sus funciones en el cáncer con el objetivo de buscar un punto débil en ellas. Concretamente, creemos que una molécula, llamada HSP90 puede ser un factor clave en este aspecto, y que utilizando inhibidores de esta molécula podemos bloquear el papel de estas células e impedir la progresión del tumor.
Para ello vamos a estudiar de forma específica la función de la molécula HSP90, su regulación y el mecanismo de acción en los fibroblastos estudiando estas células en cultivos de células sanas y de células de cáncer de mama, ovario y colon.
Estudio de las estrategias de reparación del ADN del cáncer para mejorar la medicina de precisión
Los tumores pueden aparecer como consecuencia de defectos de reparación del ADN, como sucede en aquellos portadores de mutaciones BRCA1 / BRCA2, responden muy bien a ciertas quimioterapias y a nuevos medicamentos dirigidos llamados inhibidores de PARP (PARPi). Hemos desarrollado una nueva prueba basada en la visualización de una molécula encargada de reparar el ADN, llamada RAD51, que permite determinar si las células tumorales tienen defectos en su capacidad de reparar el ADN, más allá de las mutaciones en BRCA1 / BRCA2.
Este proyecto tiene como objetivo establecer el valor predictivo del test que hemos desarrollado en el laboratorio basado en el análisis de la molécula RAD51 en cuatro tipos principales de cáncer (mama, ovario, próstata y endometrio). Queremos comprobar si la prueba proporciona evidencias funcionales para la interpretación de diferentes alteraciones genéticas de importancia desconocida.
Además, mejoraremos la prueba para permitir su implementación en la clínica y realizaremos una evaluación económica para comparar nuestra prueba frente a los criterios de selección actuales para las indicaciones terapéuticas de PARPi (un fármaco utilizado para tratar estos tumores).
Resultados destacados:
Alteración de los patrones de splicing en genes de susceptibilidad a cáncer de mama: Análisis funcional mediante mini-genes híbridos.
El 10% de los casos de cáncer de mama son de carácter hereditario, es decir que se deben a mutaciones o alteraciones en determinados genes que son susceptibles o de predisposición al desarrollo de este tipo de tumores, y se pueden heredar.
Con todos los datos que tenemos hasta el momento podríamos explicar a lo sumo el 50% de los casos de cáncer de mama hereditario, sin embargo, una proporción de las alteraciones en estos genes se desconocen a nivel clínico. Por ello, el objetivo de este proyecto es determinar el conjunto de genes y variantes en dichos genes implicadas en este tipo de cáncer, y su aportación al riesgo de padecer cáncer de mama.
Uno de los mecanismos que afecta a los genes involucrados en cáncer de mama hereditario es la desregulación del splicing, un proceso por el que se ‘’selecciona’’ la información concreta de un gen que se necesita para formar la molécula correspondiente (ARN). El estudio de este proceso de splicing es uno de los puntos clave de esta investigación.
La gran cantidad de variantes de ADN no conocidas que se detecten en todos los genes de predisposición se analizarán con herramientas bioinformáticas para identificar mutaciones relacionadas con el splicing, las cuales serán testadas mediante una tecnología conocida como ‘’mini-genes híbridos’’, una construcción artificial que permite mimetizar cómo estarían funcionando esos genes relacionados con la enfermedad.
Este estudio forma parte del proyecto europeo H2020 BRIDGES (Breast Cancer Risk after Diagnostic Gene Sequencing) que pretende estudiar 37 genes de susceptibilidad a cáncer de mama en 30.000 pacientes y 30.000 controles con el objetivo de clarificar el panorama genético de este tipo de tumor y estimar de forma precisa y personalizada el riesgo de cáncer de mama asociado a las variantes genéticas detectadas.
Los resultados de esta investigación permitirán reclasificar alteraciones genéticas hereditarias desconocidas a nivel clínico, mejorando el conocimiento sobre la predisposición y la prevención, además de mejores diagnósticos y nuevos tratamientos personalizados.
Cáncer de mama positivo para HER2: Nuevas terapias
El cáncer de mama es una enfermedad heterogénea que engloba a varios tipos de tumores distintos. Uno de ellos, que representa un 15-30% del total de casos, se denomina positivo para HER2 por que presenta cantidades excesivas de dicho componente celular.
Hasta hace unos años los tumores positivos para HER2 tenían un mal pronóstico; en la actualidad disponemos de distintos fármacos antiHER2 que han aumentado sobremanera la supervivencia de las pacientes con estos tumores. Sin embargo algunos tumores no responden a los fármacos anti-HER2 y otros adquieren resistencia a ellas, por lo que es necesario identificar los factores que provocan la aparición de dichas resistencias y desarrollar nuevas terapias para atajarlas.
En la propuesta describimos un proyecto de investigación multidisciplinar en el que un equipo de biólogos moleculares, oncólogos médicos, patólogos, radiólogos y cirujanos alcanzará estos objetivos, lo que resultará en tratamiento más efectivos de los tumores positivos para HER2.
Inmunoterapia personalizada en cáncer de mama avanzado mediante infusión de linfocitos T CD3+/PD1+
En la última década, la inmunoterapia ha revolucionado el tratamiento contra el cáncer consiguiendo aumentar la supervivencia. Este tratamiento consiste en activar el propio sistema inmunológico del paciente.
Para activarlo, existen numerosos tipos de aproximaciones desde fármacos hasta un tipo de tratamiento más personalizado llamado Terapia Celular Adoptiva o TCA.
La TCA es un tipo de inmunoterapia que en su forma más general consiste en aislar las células sistema inmunológico del propio paciente y, en el laboratorio, manipularlas para posteriormente devolverlas al paciente mediante una trasfusión para que ataque su cáncer. Hasta la fecha, la TCA por si sola ha obtenido resultados limitados. Ahora bien, 2 avances claves han vuelto la atención a la TCA. Por un lado, la posibilidad tecnológica de seleccionar el tipo de células inmunológicas a trasfundir. Por otro lado, la posibilidad de combinar hoy en día la TCA con otros fármacos. Por ejemplo, en el 2018, el National Cancer Institute de Estados Unidos obtuvo una remisión completa en una paciente con cáncer de mama avanzado refractaria a los tratamientos estándar mediante el tratamiento de TCA con selección de linfocitos y un fármaco anti-PD1 llamado pembrolizumab.
En esta dirección, los 4 grupos de investigación que componen esta propuesta (FCRB-Hospital Clinic de Barcelona, Hospital Universitario 12 de Octubre, Clínica Universidad de Navarra y VHIO) hemos identificado que un marcador llamado PD-1 nos podría ayudar a mejorar la TCA. Por lo tanto, proponemos realizar un ensayo clínico para valorar la seguridad y eficacia de la TCA mediante el marcador PD1 en pacientes con cáncer de mama avanzado. Este sería el primer paso para implementar una terapia pionera y académica en nuestro país para el cáncer de mama y otros tumores sólidos de forma similar a lo ocurrido con otra inmunoterapia en leucemias.
Re-educar fibroblastos ‘’corruptos’’ como nueva terapia contra el cáncer
A pesar de avances significativos en su diagnóstico y tratamiento, el cáncer sigue siendo una de las principales causas de muerte en el mundo, con aproximadamente 9,6 millones de muertes relacionadas. Es por tanto de vital importancia mejorar nuestro conocimiento de la enfermedad para así lograr desarrollar nuevas maneras de tratarla eficazmente.
Es importante resaltar que el cáncer no está solo compuesto de células tumorales, sino que, como cualquier otro órgano, también contiene células sanas como por ejemplo células inmunes o fibroblastos, entre otras. Sin embargo, en cáncer, muchas de estas células normales están corrompidas y no desarrollan su función normal; al contrario, pueden ayudar a la aparición, crecimiento y diseminación de la enfermedad. Esto sugiere que modular estas células podría ser una nueva vía para el tratamiento del cáncer, una idea respaldada en el éxito reciente de las terapias dirigidas contra las células inmunes (o inmunoterapia).
En este proyecto buscamos identificar estrategias que permitan modular a otro tipo de célula sana en tumores: los fibroblastos asociados a cáncer (CAFs). Estas células son muy abundantes en la mayoría de los tumores sólidos y contribuyen críticamente al desarrollo de cánceres más agresivos, lo cual sugiere que estrategias capaces de “re-educarlas” hacia comportamientos menos corruptos podrían suponer una nueva forma de combatir la enfermedad que beneficie a los pacientes. Para llegar a ese punto, es necesario conocer por qué y cómo los fibroblastos en tumores son corrompidos, y cómo esa corrupción les permite contribuir al desarrollo de la enfermedad. Resultados previos de nuestro grupo han identificado unas moléculas como factores esenciales para la generación de CAFs, lo que sugiere que bloquear la actividad de estas moléculas podría tener potencial terapéutico.
En este proyecto buscamos confirmar estos hallazgos y delinear exactamente cómo dichas moléculas promueven la actividad corrupta de los CAFs, así como utilizar esta información para ayudar a mejorar el diagnóstico y tratamiento de pacientes con cáncer.
Estudio de los mecanismos que controlan la visibilidad de las células cancerosas al sistema inmune durante la metástasis del cáncer de mama.
El sistema inmune representa uno de los principales mecanismos naturales de defensa para evitar y bloquear la aparición de tumores.
En este proyecto estudiaremos la habilidad de las células cancerosas más agresivas para escapar de la detección inmune y así la aparición de tumores y metástasis. Estas células más agresivas reciben el nombre de células madre cancerosas porque son las que generan el tumor y dan lugar al resto de células tumorales. Tienen una serie de características que las hace más agresivas y entre otras cosas creemos que es debido a su capacidad de no ser detectadas por el sistema inmune.
Pretendemos entender los mecanismos moleculares que controlan su visibilidad al sistema inmune en cáncer de mama metastásico, y así diseñar nuevas terapias contra estos mecanismos para hacerlas más visibles y explotar el sistema inmune en combinación con inmunoterapia para que las elimine.
Resultados destacados:
Desarrollo de nuevas terapias para el cáncer de mama HER2+
En general el pronóstico de los pacientes de cáncer ha mejorado en los últimos años principalmente debido al desarrollo de nuevas terapias dirigidas. Sin embargo, la eficacia de tales tratamientos sigue siendo todavía limitada, debido a dos problemas principales. Por un lado, la adquisición de mecanismos de resistencia a estos fármacos por las células cancerosas, y por otro, la dificultad de tratar tumores con metástasis en otros órganos, especialmente en el cerebro, donde la mayoría de las terapias no pueden alcanzar a las células tumorales.
Como ejemplo de estos problemas destacan los tumores llamados “HER2-positivos” que se caracterizan por tener niveles elevados de una molécula llamada HER2, que promueve el desarrollo de tumores. Esta alteración afecta a un gran número de pacientes (en torno al 20% y 30% de los tumores de mama y estómago, respectivamente). Estos tumores son agresivos, proclives a hacer metástasis, diseminarse a otras partes del organismo (los de mama HER2+ especialmente a cerebro) y por tanto se asocian a mal pronóstico y reducida supervivencia general del paciente.
Aunque estos tumores se tratan con fármacos específicos contra la molécula HER2, su efecto es limitado y muchos pacientes (más de 7.000 por año en España) no responden bien a la terapia. En nuestro laboratorio hemos demostrado que tener elevados niveles de otra molécula, llamada Gasdermina-B (GSDMB), en las células tumorales HER2+ promueve que el tumor sea resistente al tratamiento, así como invasión tumoral y metástasis. Aún más importante, hemos observado que atacar a esta molécula (GSDMB) puede representar una nueva aproximación terapéutica en tumores HER2+, ya que nuestros tratamientos experimentales preliminares contra la misma, han mostrado resultados muy prometedores al reducir el crecimiento tumoral y resistencia a terapias convencionales.
Basándonos en estos resultados, en este proyecto planeamos identificar y avanzar en el desarrollo de mejores fármacos ‘’anti-GSDMB’’. Los resultados del proyecto tendrían dos utilidades clínicas. Por un lado, ayudar a evitar la resistencia tumoral a terapias anti-HER2, y por el otro prevenir la metástasis, especialmente a cerebro, uno de los desafíos actuales de la oncología. Nuestro objetivo final es desarrollar opciones terapéuticas nuevas y patentables que puedan ser trasladadas en un futuro próximo a pacientes con estos tumores agresivos.
Resultados destacados:
- Una nueva estrategia contra la resistencia a los tratamientos para el cáncer de mama HER2+
- Avances hacia la medicina personalizada del cáncer de endometrio tras identificar las diferencias en su composición
Inmunoterapia con linfocitos T reprogramados frente a tumores metastásicos
La terapia celular adoptiva con linfocitos T (una técnica por la que se extraen estas células inmunes de un paciente y se manipulan para que puedan acabar con un tumor) es uno de los tratamientos más efectivos para el melanoma metastásico. Sin embargo, estos resultados no son tan favorables en otros tipos de tumores.
Los principales desafíos de esta técnica en tumores sólidos son la incapacidad de las ‘’células entrenadas’’ para penetrar en el tumor (linfocitos T infiltrantes) y la influencia de factores del ambiente que rodea al mismo que impiden que dichas células actúen adecuadamente. El desarrollo de técnicas para la modificación células inmunes, y su utilización para inducir la regresión tumoral en pacientes con leucemia y linfoma, ha impulsado el desarrollo de nuevas estrategias de terapia celular adoptiva para el tratamiento de tumores epiteliales (de piel).
En este proyecto, proponemos realizar una reprogramación genética de linfocitos T infiltrantes aislados de pacientes con tumores de pulmón y mama, para prepararlos con el fin de que puedan reconocer determinadas moléculas específicas de estos tumores y un novedoso tipo de anticuerpo biespecífico, un fármaco que ayude a que esta terapia sea más efectiva bloqueando aquellos factores del tumor que impiden que las células inmunes puedan funcionar bien, a la vez que redirige a dichas células hacia las células tumorales para encontrarlas y acabar con ellas.
El objetivo es contrarrestar las estrategias del tumor que dificultan el éxito de estas terapias para conseguir una reducción significativa de la masa tumoral y desarrollar una respuesta del sistema inmunitario más específica para dar el golpe definitivo al tejido tumoral residual.
Resultados destacados:
Prevención y detección temprana de recaída en pacientes con cáncer de mama usando muestras de sangre
Este proyecto propone un novedoso estudio para el uso de componentes tumorales en la circulación sanguínea, rastros de un cáncer que permitan prevenir y/o detectar de manera anticipada recaídas en la enfermedad en aquellas pacientes con cáncer de mama qué tengan más posibilidades de recaer o estén recayendo después de la cirugía.
Para este estudio necesitaremos la donación voluntaria de sangre por parte de pacientes con cáncer de mama temprano tanto al inicio del diagnóstico de la enfermedad como después de la cirugía, así como durante un seguimiento continuo.
Los resultados obtenidos a través de estas investigaciones pueden suponer el inicio del uso de nuevas técnicas para detectar recaídas de manera temprana en el cáncer de mama, con el consiguiente importante beneficio para la curación de los pacientes. Además, estas investigaciones pueden representar un punto de inflexión necesario en el tratamiento personalizado a estas pacientes de cáncer en la práctica clínica.
Resultados destacados:
Evaluación de las nuevas estrategias de irradiación en el tratamiento del cáncer de mama y su implementación en la clínica
Más de 22.000 personas son diagnosticadas cada año en España de cáncer de mama. Para combatirlo, el tratamiento habitual después de la cirugía conservadora es la radioterapia, la cual aumenta considerablemente las posiblidades de supervivencia. Actualmente existen técnicas radioterápicas avanzadas como la IMRT y VMAT que permiten conformar mejor la dosis en el tejido tumoral respecto técnicas convencionales reduciendo las dosis altas en el tejido sano. Todo esto es de especial interés en tratamientos a la mama izquierda, donde el corazón se encuentra muy próximo a la lesión.
En contrapartida respecto a la técnica tradicional (3D conformada), aumentan las dosis bajas en el tejido sano así como la toxicidad en piel en algunos casos. La mama posee además movimiento respiratorio, que afecta a la posición del tumor. En la actualidad, diversos grupos de investigación han demostrado la superioridad dosimétrica de las técnicas de inspiración profunda mantenida sobre una irradiación con respiración libre. Existe además la posibilidad de sincronizar la irradiación con la respiración e irradiar únicamente en una fase del ciclo respiratorio (gating).
El objetivo de este estudio es evaluar cuál es la técnica más adecuada para cada tipo de mama y cuál la mejor manera de implementarlo en la clínica
Comparación de la eficacia antitumoral de cannabinoides aislados frente a preparados completos de la planta
Existe evidencia preclínica muy abundante y sólida que demuestra que determinados cannabinoides poseen propiedades antitumorales, destacando:
- Inducción de muerte celular programada en diversos tipos celulares
- Bloqueo de la producción de vasos sanguíneos (cruciales para la supervivencia del tumor).
- Bloqueo de la generación de metástasis, interfiriendo con la capacidad invasiva y migratoria de las células tumorales.
Síntesis y evaluación biológica de agentes anticáncer multidiana con efecto inmunomodulador, antiangiogénico y antivascular
Conocemos por cáncer al conjunto de enfermedades que se caracteriza por la incontrolada proliferación de células anormales. El cáncer de mama aparece cuando estas células anormales se encuentran en el epitelio glandular del pecho formando lo que se conoce como tumor, este tipo de cáncer afecta en mayor proporción a las mujeres. Por otra parte en el cáncer de pulmón la célula sana que se transforma en la célula tumoral está en el epitelio que reviste todo el árbol respiratorio desde la tráquea hasta el bronquiolo terminal más fino.
El proyecto tiene como finalidad encontrar un nuevo tratamiento para el cáncer de mama y pulmón con menos efectos secundarios que los fármacos disponibles en el mercado.








































































